-
葡萄糖 编辑
中文名:葡萄糖
外文名:glucose
别名:(2R,3S,4R,5R)-2,3,4,5,6-五羟基己醛、玉米葡糖、玉蜀黍糖
化学式:C6H12O6
分子量:180.16
CAS登录号:50-99-7
EINECS登录号:200-075-1
熔点:146℃
沸点:527.1℃
水溶性:易溶
密度:1.581g/cm³
外观:白色无臭结晶性颗粒或晶粒状粉末
闪点:286.7℃
安全性描述:S26;S36/37;S24/25
危险性符号:R36/37/38
危险性描述:Xi
缩写:GLC、GLU(血糖)
1747年,德国化学家马格拉夫(S·Marggraf)在柏林 首次分离出葡萄糖,并于1749年将这一过程发表在《从德国产的几种植物中提炼蔗糖的化学试验》 一文内,第90页中写道:”用少量的水润湿葡萄干将其软化,然后压榨被挤出的汁,经过提纯浓缩后,得到了一种糖。马格拉夫发现的这种糖就是葡萄糖。
然而,葡萄糖直到1838年才被命名,它的英文名glucose源自于法语的glucose,它是由法国教授尤金-梅尔後佩利戈(Eugène-Melchior Péligot)(1811-1890)首次创造,源自德语中的gleukos——未发酵的甜果酒,前缀gluc-源于德语glykys,即甘甜的意思,后缀-ose则表明其化学分类,指出它是一个碳水化合物。
同年,路易斯·贾奎斯·泰纳尔(Louis JacquesThénard)、约瑟夫·路易·盖-吕萨克(Joseph Louis Gay-Lussac)、让-巴蒂斯特·毕奥(Jean-Baptiste Biot)和让-巴蒂斯特·安德烈·杜马(Jean Baptiste AndreDumas)四位法国科学家联名发表一篇对于後佩利戈先生的学术论文集的综述,其名为《对于自然和糖的化学性质的研究》,其109页中写道:“那些来源自葡萄、淀粉、蜂蜜甚至导致糖尿病的物质具有相同的构成和属性,将这种单一物质命名为葡萄糖。
由于葡萄糖在生物体中的重要地位,了解其化学组成和结构成为19世纪有机化学的重要课题。1884年,埃米尔·费歇尔(Fischer)开始研究糖类。当时所知的单糖只有4种:两种己醛糖(葡萄糖、半乳糖)、两种己酮糖(果糖 、山梨糖),它们具有相同的分子式C6H12O6,慕尼黑大学的化学家吉连尼 ( H.iKhani ) 初步探明葡萄糖和半乳糖是直链的五羟基醛,果糖和山梨糖是直链的五羟基酮。
 百科x混知:图解单糖和多糖
百科x混知:图解单糖和多糖
费歇尔发现,葡萄糖、果糖和甘露糖与苯脐生成相同的脉,因此推断,这三种糖在第二个碳原子以下具有相同的构型。根据范特霍夫(Van’t Hoff)和勒贝尔(eLeBl)的立体异构理论,费歇尔推断,己醛糖有16种可能的构型,用氧化、还原、降解、加成等方法,到1891年,他确定了D-己醛糖所有成员的构型。 1892年德国化学家费歇尔确定了葡萄糖的链状结构及其立体异构体,并由于其在立体化学的巨大成就,获得1902年诺贝尔化学奖。
2022年4月,中国科学家通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖和油脂。这一成果由电子科技大学、中国科学院深圳先进技术研究院与中国科学技术大学共同完成, 2022年4月28日以封面文章形式在国际学术期刊《自然—催化》发表。
2023年8月15日,著名学术期刊《科学通报》刊发最新研究成果显示,中国科学家在实验室内实现了从二氧化碳到糖的精准全合成,人工合成糖迈出关键一步。此次研究成果由中国科学院天津工业生物技术研究所与大连化学物理研究所科研团队历时两年多攻关完成。团队将高浓度二氧化碳等原料在反应溶液中按一定比例调配,在化学催化剂和酶催化剂的作用下,得到了葡萄糖、阿洛酮糖、塔格糖、甘露糖4种己糖。己糖是在自然界广泛分布,与机体营养代谢最为密切的糖的统称。
理化性质
安全信息
危险类别码:R36/37/38
安全说明:S36/37/39-S26
异构体
同分异构体
阿洛酮糖(psicose,allulose);果糖(fruCTose);山梨糖(sorbose);塔格酮糖(tagalose);肌醇(iNOsitol)
手性异构体
阿洛糖(allose);阿卓糖(altrose);甘露糖(mannose);古洛糖(gluose);艾杜糖(idose);半乳糖(galactose);塔罗糖(talose)
旋光异构体
α-D-呋喃葡萄糖;β-D-呋喃葡萄糖;
α-D-吡喃葡萄糖;β-D-吡喃葡萄糖;
贮藏
在干燥的条件下,葡萄糖具有良好的稳定性,水溶液可经高压灭菌。过热可导致溶液pH值的下降和焦糖化。
散装成品应在干燥、低温密闭容器中贮藏。
验证醛基
葡萄糖验证:
⒈葡萄糖溶液与新制氢氧化铜悬浊液反应生成砖红色沉淀。(浓度高时生成黄色沉淀)
注意事项:⑴ 新制Cu(OH)2悬浊液要随用随配、不可久置。
⑵ 配制新制Cu(OH)2悬浊液时,所用NaOH溶液必须过量。
⑶ 反应液必须直接加热至沸腾。
⑷ 葡萄糖分子中虽然含有醛基,但是d-葡萄糖中不含有醛基。
⒉葡萄糖溶液与银氨溶液反应有银镜反应
⑵ 银氨溶液随用随配不可久置;
⑶ 水浴加热,不可用酒精灯直接加热;
⑷ 可加入氢氧化钠,以促进反应进行;
⑸ 银镜可用稀HNO3浸泡洗涤除去。
加热还原生成的银附着在试管壁上,形成银镜,所以,这个反应也叫银镜反应。
中枢神经系统几乎全部依赖血糖的供应作为能源,一旦血糖上升到80毫克%时可能出现糖尿现象。
工业上葡萄糖由淀粉水解制得,60年代应用微生物酶法生产葡萄糖。这是一项重大革新,比酸水解法有明显的优点。在生产中原料不必精制,不需耐酸、耐压的设备,而且糖液无苦味,产糖率高。
葡萄糖在医学上主要用作注射用营养剂(葡萄糖注射液)。
食品工业上葡萄糖经异构酶处理后可制造果糖,尤其是含果糖42%的果葡糖浆,其甜度同蔗糖,已成为当前制糖工业的重要产品。
葡萄糖是生物体内新陈代谢不可缺少的营养物质。它的氧化反应放出的热量是人类生命活动所需能量的重要来源。在食品、医药工业上可直接使用,在印染制革工业中作还原剂,在制镜工业和热水瓶胆镀银工艺中常用葡萄糖作还原剂。工业上还大量用葡萄糖为原料合成维生素C(抗坏血酸)。
代谢功能
葡萄糖很容易被吸收进入血液中,因此医院人员、运动爱好者以及平常人们常常使用它当作强而有力的快速能量补充。
葡萄糖加强记忆,刺激钙质吸收和增加细胞间的沟通。但是太多会提高胰岛素的浓度,导致肥胖和糖尿病;太少会造成低血糖症或者更糟,胰岛素休克(糖尿病昏迷)。葡萄糖对脑部功能很重要,葡萄糖的新陈代谢会受下列因素干扰:忧郁、躁郁、厌食和贪食。阿尔兹海默症病人纪录到比其他脑部功能异常更低的葡萄糖浓度,因而造成中风或其他的血管疾病。研究员发现在饮食补充75克的葡萄糖会增加记忆测验的成绩。
葡萄糖被吸收到肝细胞中,会减少肝糖的分泌,导致肌肉和脂肪细胞增加葡萄糖的吸收力。过多的血液葡萄糖会在肝脏和脂肪组织中转换成脂肪酸和甘油三酸脂。
适应症
葡萄糖临床应用广泛,用于各种高热、脱水、昏迷或不能进食的患者所需的水分和热量。体内丢失大量体液时,如吐泻、大失血等可先静脉滴注5%~10%葡萄糖和生理盐水以补充水、盐和糖分,并用于低血糖、药物毒物中毒者。静脉滴注25%~50%的高渗溶液,因其高渗压作用,可使组织脱水和短暂利尿,与甘露醇联合交替应用治疗脑水肿、肺水肿及降低眼压。静脉滴注高渗葡萄糖治疗血糖过低。与胰岛素合用,因可促进钾转移入细胞内,也是高钾血症治疗措施之一。
分解途径
天然的葡萄糖,无论是游离的或是结合的,均属D构型,在水溶液中主要以吡喃式构形含氧环存在,为α和β两种构型的衡态混合物。在常温条件下,可以α-D-葡萄糖的水合物(含1个水分子)形式从过饱和的水溶液中析出晶体,熔点为80℃;而在50~115℃之间析出的晶体则为无水α-D-葡萄糖,熔点146℃。115℃以上析出的稳定形式则为β-D-葡萄糖,熔点为148~150℃。呋喃环形式的葡萄糖仅以结合状态存在于少数天然化合物中。
D-葡萄糖具有一般醛糖的化学性质:在氧化剂作用下,生成葡萄糖酸,葡萄糖二酸或葡萄糖醛酸;在还原剂作用下,生成山梨醇;在弱碱作用下,葡萄糖可与另两种结构相近的六碳糖──果糖和甘露糖──三者之间通过烯醇式相互转化。葡萄糖还可与苯肼结合,生成葡萄糖脎,后者在结晶形状和熔点方面都与其他糖脎不同,可作为鉴定葡萄糖的手段。
大多数生物具有酶系统可分解D-葡萄糖以取得能量的能力。在活细胞中,例如哺乳动物的肌肉细胞或单细胞的酵母细胞中,葡萄糖先后经过不需氧的糖酵解途径、需氧的三羧酸循环以及生物氧化过程生成二氧化碳和水,释放出较多的能量,以ATP(三磷酸腺苷)形式贮存起来,供生长、运动等生命活动之需。在无氧的情况下,葡萄糖仅仅被分解生成乳酸或乙醇,释放出的能量少得多,酿酒是无氧分解的过程。工业上,用酸或酶水解淀粉制得的葡萄糖可用做食品、制酒、制药等工业生产的原料。
2020年版《中国药典》目录二部 1268页
本品为D-(+)-吡喃葡萄糖一水合物。
【性状】本品为无色结晶或白色结晶性或颗粒性粉末;无臭,味甜。
本品在水中易溶,在乙醇中微溶。
比旋度 取本品约10g,精密称定,置100mL量瓶中,加水适量与氨试液0.2mL,溶解后,用水稀释至刻度,摇匀,放置10分钟,在25℃时,依法测定(通则 0621),比旋度为+52.6°至+53.2°。
【鉴别】(1)取本品约0.2g,加水5ml溶解后,缓缓滴入微温的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
(2)取干燥失重项下的本品适量,依法测定,本品的红外光吸收图谱应与对照的图谱(光谱集 702图)一致。
【检查】酸度 取本品2.0g,加水20ml溶解后,加酚酞指示液3滴与氢氧化钠滴定液(0.02mol/L)0.20mL,应显粉红色。
溶液的澄清度与颜色 取本品5.0g,加热水溶解后,放冷,用水稀释至10mL,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则 0902第一法)比较,不得更浓;如显色,与对照液(取比色用氯化钴液3.0mL、比色用重铬酸钾液3.0mL与比色用硫酸铜液6.0mL,加水稀释成50mL)1.0mL加水稀释至10mL比较,不得更深。
乙醇溶液的澄清度 取本品1.0g,加乙醇20mL,置水浴上加热回流约40分钟,溶液应澄清。
氯化物 取本品0.60g,依法检查(通则 0801),与标准氯化钠溶液6.0mL制成的对照液比较,不得更浓(0.01%)。
硫酸盐 取本品2.0g,依法检查(通则 0802),与标准硫酸钾溶液2.0mL制成的对照液比较,不得更浓(0.01%)。
亚硫酸盐与可溶性淀粉 取本品1.0g,加水10mL溶解后,加碘试液1滴,应即显黄色。
干燥失重 取本品,在105℃干燥至恒重,减失重量为7.5%~9.5%(通则 0831)。
炽灼残渣 不得过0.1%(通则 0841)。
蛋白质 取本品1.0g,加水10mL溶解后,加磺基水杨酸溶液(1→5)3mL,不得发生沉淀。
钡盐 取本品2.0g,加水20mL溶解后,溶液分成两等份,一份中加稀硫酸1mL,另一份中加水1mL,摇匀,放置15分钟,两液均应澄清。
钙盐 取本品1.0g,加水10mL溶解后,加氨试液1mL与草酸铵试液5mL,摇匀,放置1小时,如发生浑浊,与标准钙溶液 1.0mL制成的对照液比较,不得更浓(0.01%)。
铁盐 取本品2.0g,加水20mL溶解后,加硝酸3滴,缓慢煮沸5分钟,放冷,用水稀释制成45mL,加硫氰酸铵溶液(30→100)3.0mL,摇匀,如显色,与标准铁溶液2.0mL用同一方法制成的对照液比较,不得更深(0.001%)。
重金属 取本品4.0g,加水23mL溶解后,加醋酸盐缓冲液(pH 3.5)2mL,依法检查(通则 0821第一法),含重金属不得过百万分之五。
砷盐 取本品2.0g,加水5mL溶解后,加稀硫酸5mL与溴化钾溴试液0.5mL,置水浴上加热约20分钟,使保持稍过量的溴存在,必要时,再补加溴化钾溴试液适量,并随时补充蒸散的水分,放冷,加盐酸5mL与水适量使成28mL,依法检查(通则 0822第一法),应符合规定(0.0001%)。
微生物限度 取本品10g,用pH 7.0无菌氯化钠-蛋白胨缓冲液制成1:10的供试液。
需氧菌总数、霉菌和酵母菌总数 取供试液1mL,依法检查(通则 1105平皿法),1g供试品中需氧菌总数不得过1000cfu,霉菌和酵母菌总数不得过100cfu。
大肠埃希菌 取1:10的供试液10mL,依法检查(通则 1106),1g供试品中不得检出。
【类别】营养药。
【贮藏】密封保存。
耐量试验
临床上做糖尿病的诊断试验时,通常是测定静脉空腹血糖。当静脉空腹血糖<5.0mmol/L,可排除糖尿病;当静脉空腹血糖>7.0mmol/L并且有临床症状时,则可以诊断为糖尿病;而当静脉空腹血糖在5.5~7.0mmol/L之间并且怀疑糖尿病时,就应该进一步做葡萄糖耐量试验——OGTT。OGTT试验是一种口服葡萄糖负荷试验,用以了解人体对进食葡萄糖后的血糖调节能力。通过OGTT试验,可以早期发现糖代谢异常,早期诊断糖尿病。
葡萄糖耐量
葡萄糖糖耐量是指机体对血糖浓度的调节能力。正常人在进食米、面主食或服葡萄糖后,几乎全被肠道吸收,使血糖升高,刺激胰岛素分泌、肝糖原合成增加,分解受抑制,肝糖输出减少,体内组织对葡萄糖利用增加,因此饭后最高血糖不超过10.0mmol/L,且进食或多或少血糖都保持在一个比较稳定的范围内。这说明正常人对葡萄糖有很强的耐受能力,即葡萄糖耐量正常。但若胰岛素分泌不足的人,口服 75g葡萄糖后2小时可超过7.8mmol/L,可等于或大于11.1mmol/L,说明此人对葡萄糖耐量已降低。
葡萄糖耐量检测
通过葡萄糖耐量实验来检测。
方法:口服一定量葡萄糖后,每间隔一定时间测定血糖,利用这一试验可了解胰岛β细胞功能和机体对糖的调节能力。
受检者口服一定量的葡萄糖后,定时测定血中葡萄糖含量,服后若血糖略有升高,两小时内恢复服前浓度为正常;若服后血糖浓度急剧升高,2--3小时内不能恢复服前浓度则为异常。临床上常对症状不明显的病人采用该实验来诊断有无糖代谢异常。
WHO标准化的OGTT:
WHO推荐成人75g葡萄糖,孕妇100g,儿童每公斤体重1.75g,总量≤75g用250ml水溶解,5分钟内口服。服糖前抽空腹血,服糖后每隔30分钟取血,共四次。采血同时每隔1小时留尿测尿糖。根据各次血糖水平绘制糖耐量曲线。
试验前三天每日食物中糖含量应不低于150 g,维持正常活动,影响试验的药物应在三天前停用。整个试验期间不可吸烟、喝咖啡、喝茶或进食。
适用症状:
①无糖尿病症状,随机或空腹血糖异常者;
②无糖尿病症状,有一过性或持续性糖尿;
③无糖尿病症状,但有明显糖尿病家族史;
④有糖尿病症状,但随机或空腹血糖不够诊断标准;
剂型
1.针剂:每支(瓶)5%(250mL,500mL),10%(500mL),25%(20mL),50%(20mL);
2.注射剂(粉):250g,500g。
药理作用
可概括为营养、解毒、强心、利尿,它是生理性糖类,也是机体所需能量的主要来源。它在体内被氧化成二氧化化碳和水并同时提供热量,以糖原形式贮存。对肝脏具有保护作用和解毒功能,并能促进毒物的排泄。
药代动力学
口服吸收迅速,进入人体被组织利用,正常人利用葡萄糖能力为6mg/kg。
禁忌症
低渗性脱水患者禁用。
注意事项
2.在使用高浓度糖液过程中,突然停用时,可能引起低血糖。
3.周围静脉滴注高渗葡萄糖易发生静脉炎和血栓,渗漏血管外可刺激局部组织。
4.葡萄糖有吸湿性,且易发霉,故在注射剂的配置和使用过程中,应严格按无菌操作。
5.冬季应先将其加热至与体温相近,再徐徐静注,以避免引起血管痉挛。
不良反应
(2)反应性低血糖。
用法用量
用量视病情而定。
普通口服
葡萄糖在人体新陈代谢中起着重要作用,因此美国药典载有葡萄糖酸钙针剂、片剂、葡萄糖酸钾、葡萄糖酸铁等并在美国大量生产。在食品加工业非常发达的日本,食品添加剂证书上明确记载葡萄糖酸、葡萄糖酸-δ-内酯、葡萄糖酸锌、葡萄糖酸钙、葡萄糖酸亚铁、葡萄糖酸铜可作为食品添加剂,以葡萄糖为原料深加工,除可制造结晶的葡萄糖酸、葡萄糖酸-δ-内酯外,还可制造各种盐,如钾、钠、钙、镁、锌、铁、铜等人体必须的微量元素,人体缺少它,就会发生疾病,如缺铁就会引起贫血,因铁是血红蛋白和肌红蛋白的组织部分,参与氧化和输送二氧化碳,过去硫酸亚铁治疗贫血,人体虽能吸收,但刺激胃肠,会引起一系列不良反应,故改用葡萄糖酸亚铁后,胃肠无明显反应,补铁效果良好,鉴于这种情况,国家规定,用葡萄糖酸的钾、钠、钙、锌、铜、铁、锰等作为人体营养强化剂及药用补充剂,此类药品均有很好的治疗效果。
长期的、科学合理的服用,对一个民族身体素质的提高是不言而喻的,据日本一资料统计,二战后日本青少年的平均身高增长了14.8cm,这与他们在食品、药品制造中科学合理的使用葡萄糖酸微量元素是密不可分的。在中国,大家熟知的葡萄糖酸钙的针剂、片剂和葡萄糖酸锌口服液都具有重要的生理功能、治疗功能,“巨能钙”“补铁口服液”热销全国就是一个充分的验证。
儿童服用
小儿正常生长发育的营养素,以糖、蛋白质及脂肪三大要素为最重要。糖类(碳水化合物)是供应体内热量的主要来源。葡萄糖是一种单糖,进入体内可被直接利用。1~6个月的婴儿,食物中的糖类主要是乳糖和少许淀粉。4个月后含淀粉食物逐渐增加,到1岁时胃肠道消化淀粉的各种酶系统逐渐完善,能迅速将其水解为葡萄糖,并在小肠吸收进入血液。吸收后可直接供给能量,或以糖原形式贮存,过量的可变成脂肪。
人体平时不进食葡萄糖,体内也不会缺乏葡萄糖,因此,平时不需补充。但当小儿在患病、拒食时,体质极度衰弱,为保证小儿基础代谢热量的需要,短时喂以葡萄糖,是可取的,有时静脉输给葡萄糖,就是这个道理。但认为葡萄糖营养价值高,过多过久的给予喂哺,而忽略其他食品供给,可影响小儿食欲,并且由于蛋白质及其它营养素得不到补充,会导致生长迟缓,严重反复感染、营养不良等。还会因血糖升高,引起一过性糖尿,而发生口渴、多饮多尿症状。
小儿消化道产生其他消化酶的腺体被废弃不用,长久会导致萎缩,消化功能更加下降,使之更不能进食其他类食物。正常小儿应尽量让其多吃淀粉类食物,练习咀嚼,以促进唾液腺的分泌,增强食欲及消化功能,并有利于颌面骨及牙齿的发育。
药物相互作用
(尚不明确)
注意事项
⑴静注高渗葡萄糖注射液时应注意药液有无漏出血管外,以免引起静脉炎,在同一部位连续注射5%-10%浓度的药液时也可发生同一并发症。
⑵治疗脑水肿使用高渗溶液时如突然停药,容易发生反跳现象并致使脑水肿再度发生,故不可突然停药,而应缓缓减量直至停用。
⑶不宜做皮下注射,以免引起皮下坏死。
(一)发酵工业
微生物的生长需要合适的碳氮比,葡萄糖作为微生物的碳源,是发酵培养基的主料,如抗生素、味精、维生素、氨基酸、有机酸、酶制剂等都需大量使用葡萄糖,同时也可用作微生物多聚糖和有机溶剂的原料。
(二)食品工业
目前结晶葡萄糖主要用于食品行业,随着生活水平的提高和食品行业科技的不断发展,葡萄糖在食品行业的应用越来越广泛,今后很长一段时间内食品行业仍是最大的市场。
(三)化学工业
葡萄糖在工业上的应用也很广,在印染制革工业中作还原剂,在制镜工业、热水瓶胆镀银及玻璃纤维镀银等化学镀银工业也常用葡萄糖作还原剂。
葡萄糖在制革工业铬鞣剂制造中的应用:铬鞣剂是制造轻革(鞋面革、服装革)的最好的鞣剂。用铬盐制革已有 100年的历史。所制皮革具有收缩温度高、弹性好、耐挠曲、耐水洗、坚实耐用等特点。铬鞣剂主要是碱式硫酸铬(也可用碱式氯化铬,但其鞣剂效果较硫酸铬差)。其制造方法是以葡萄糖或二氧化硫为还原剂,在硫酸溶液中将重铬酸盐还原成碱式硫酸铬,即制成铬鞣液,鞣液经浓缩、干燥后,可得到粉状铬鞣剂。
(四)合成和转化
葡萄糖可氢化、氧化、异构、碱性降解、酯化、乙缩醛化反应等,合成或转化为其他产品。如氢化制山梨醇;氧化制葡萄糖醛酸、二酸等,并可进一步制成酸钙、酸钠、酸锌以及葡萄糖酸δ内酯;异构化为F42、F55、F90果葡糖浆和结晶果糖;也可异构化为甘露糖(生产甘露糖醇原料),其中山梨醇可进一步生成维生素C,被广泛应用于临床治疗,而且甘露醇15%在临床作为一种安全有效的降低颅内压药物,来治疗脑水肿和青光眼。
0
有用+1
已投票
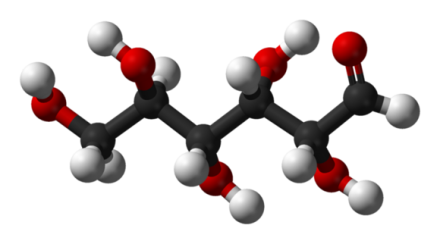
葡萄糖(glucose),有机化合物,分子式C6H12O6。是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛。纯净的葡萄糖为无色晶体,有甜味但甜味不如蔗糖,易溶于水,微溶于乙醇,不溶于乙醚。天然葡萄糖水溶液旋光向右,故属于“右旋糖”。
葡萄糖在生物学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质。植物可通过光合作用产生葡萄糖。在糖果制造业和医药领域有着广泛应用。
1747年,德国化学家马格拉夫(S·Marggraf)在柏林 首次分离出葡萄糖,并于1749年将这一过程发表在《从德国产的几种植物中提炼蔗糖的化学试验》 一文内,第90页中写道:”用少量的水润湿葡萄干将其软化,然后压榨被挤出的汁,经过提纯浓缩后,得到了一种糖。马格拉夫发现的这种糖就是葡萄糖。
然而,葡萄糖直到1838年才被命名,它的英文名glucose源自于法语的glucose,它是由法国教授尤金-梅尔後佩利戈(Eugène-Melchior Péligot)(1811-1890)首次创造,源自德语中的gleukos——未发酵的甜果酒,前缀gluc-源于德语glykys,即甘甜的意思,后缀-ose则表明其化学分类,指出它是一个碳水化合物。
同年,路易斯·贾奎斯·泰纳尔(Louis JacquesThénard)、约瑟夫·路易·盖-吕萨克(Joseph Louis Gay-Lussac)、让-巴蒂斯特·毕奥(Jean-Baptiste Biot)和让-巴蒂斯特·安德烈·杜马(Jean Baptiste AndreDumas)四位法国科学家联名发表一篇对于後佩利戈先生的学术论文集的综述,其名为《对于自然和糖的化学性质的研究》,其109页中写道:“那些来源自葡萄、淀粉、蜂蜜甚至导致糖尿病的物质具有相同的构成和属性,将这种单一物质命名为葡萄糖。
由于葡萄糖在生物体中的重要地位,了解其化学组成和结构成为19世纪有机化学的重要课题。1884年,埃米尔·费歇尔(Fischer)开始研究糖类。当时所知的单糖只有4种:两种己醛糖(葡萄糖、半乳糖)、两种己酮糖(果糖 、山梨糖),它们具有相同的分子式C6H12O6,慕尼黑大学的化学家吉连尼 ( H.iKhani ) 初步探明葡萄糖和半乳糖是直链的五羟基醛,果糖和山梨糖是直链的五羟基酮。
费歇尔发现,葡萄糖、果糖和甘露糖与苯脐生成相同的脉,因此推断,这三种糖在第二个碳原子以下具有相同的构型。根据范特霍夫(Van’t Hoff)和勒贝尔(eLeBl)的立体异构理论,费歇尔推断,己醛糖有16种可能的构型,用氧化、还原、降解、加成等方法,到1891年,他确定了D-己醛糖所有成员的构型。 1892年德国化学家费歇尔确定了葡萄糖的链状结构及其立体异构体,并由于其在立体化学的巨大成就,获得1902年诺贝尔化学奖。
2022年4月,中国科学家通过电催化结合生物合成的方式,将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖和油脂。这一成果由电子科技大学、中国科学院深圳先进技术研究院与中国科学技术大学共同完成, 2022年4月28日以封面文章形式在国际学术期刊《自然—催化》发表。
2023年8月15日,著名学术期刊《科学通报》刊发最新研究成果显示,中国科学家在实验室内实现了从二氧化碳到糖的精准全合成,人工合成糖迈出关键一步。此次研究成果由中国科学院天津工业生物技术研究所与大连化学物理研究所科研团队历时两年多攻关完成。团队将高浓度二氧化碳等原料在反应溶液中按一定比例调配,在化学催化剂和酶催化剂的作用下,得到了葡萄糖、阿洛酮糖、塔格糖、甘露糖4种己糖。己糖是在自然界广泛分布,与机体营养代谢最为密切的糖的统称。
⒈旋光性
α-D-葡萄糖在20℃时的比旋光度数值为+52.2°。
⒉溶解度
在20℃时单一的葡萄糖溶液最高浓度为50%。
⒊甜度
α-D-葡萄糖的比甜度为0.7。
⒋黏度
葡萄糖的黏度随着温度的升高而增大。
密度:1.581g/cm
储存条件:2-8ºC
它是自然界分布最广泛的单糖。葡萄糖含五个羟基,一个醛基,具有多元醇和醛的性质。
在碱性条件下加热易分解。应密闭保存。口服后迅速吸收,进入人体后被组织利用。1mol葡萄糖经人体完全氧化反应后放出2870kJ能量,这些能量有部分能量转化为30或32 mol ATP,其余能量以热能形式散出从而维持人体体温,也可通过肝脏或肌肉转化成糖原或脂肪贮存。
(1)分子中的醛基,有还原性,能与银氨溶液反应,被氧化成葡萄糖酸铵。
(2)醛基还能被还原为己六醇。
(3)分子中有多个羟基,能与酸发生酯化反应。
(4)葡萄糖在生物体内发生氧化反应,放出热量。
(6)植物光合作用。
(7)葡萄糖与新制氢氧化铜反应。
(8)葡萄糖在一定条件下分解成为水和二氧化碳。
(9)麦芽糖的水解。
(10)淀粉和纤维素水解。
1.由食用玉米淀粉用食品级酸和/或酶部分水解后所得的糖类水溶液,经净化、浓缩而成。由于水解程度的不同,所含D-葡萄糖的量,可相差很大。由玉米淀粉制得者,示称“玉米糖浆”。
2.葡萄糖可以淀粉为原料,经盐酸或稀硫酸水解制得。也可以淀粉为原料在淀粉糖化酶的作用下而制得。
危险类别码:R36/37/38
安全说明:S36/37/39-S26
阿洛酮糖(psicose,allulose);果糖(fructose);山梨糖(sorbose);塔格酮糖(tagalose);肌醇(inositol)
阿洛糖(allose);阿卓糖(altrose);甘露糖(mannose);古洛糖(gluose);艾杜糖(idose);半乳糖(galactose);塔罗糖(talose)
α-D-呋喃葡萄糖;β-D-呋喃葡萄糖;
α-D-吡喃葡萄糖;β-D-吡喃葡萄糖;
在干燥的条件下,葡萄糖具有良好的稳定性,水溶液可经高压灭菌。过热可导致溶液pH值的下降和焦糖化。
散装成品应在干燥、低温密闭容器中贮藏。
葡萄糖验证:
注意事项:⑴ 新制Cu(OH)2悬浊液要随用随配、不可久置。
⑵ 配制新制Cu(OH)2悬浊液时,所用NaOH溶液必须过量。
⑶ 反应液必须直接加热至沸腾。
⑷ 葡萄糖分子中虽然含有醛基,但是d-葡萄糖中不含有醛基。
⑵ 银氨溶液随用随配不可久置;
⑶ 水浴加热,不可用酒精灯直接加热;
⑷ 可加入氢氧化钠,以促进反应进行;
⑸ 银镜可用稀HNO3浸泡洗涤除去。
加热还原生成的银附着在试管壁上,形成银镜,所以,这个反应也叫银镜反应。
中枢神经系统几乎全部依赖血糖的供应作为能源,一旦血糖上升到80毫克%时可能出现糖尿现象。
工业上葡萄糖由淀粉水解制得,60年代应用微生物酶法生产葡萄糖。这是一项重大革新,比酸水解法有明显的优点。在生产中原料不必精制,不需耐酸、耐压的设备,而且糖液无苦味,产糖率高。
葡萄糖在医学上主要用作注射用营养剂(葡萄糖注射液)。
食品工业上葡萄糖经异构酶处理后可制造果糖,尤其是含果糖42%的果葡糖浆,其甜度同蔗糖,已成为当前制糖工业的重要产品。
葡萄糖是生物体内新陈代谢不可缺少的营养物质。它的氧化反应放出的热量是人类生命活动所需能量的重要来源。在食品、医药工业上可直接使用,在印染制革工业中作还原剂,在制镜工业和热水瓶胆镀银工艺中常用葡萄糖作还原剂。工业上还大量用葡萄糖为原料合成维生素C(抗坏血酸)。
葡萄糖很容易被吸收进入血液中,因此医院人员、运动爱好者以及平常人们常常使用它当作强而有力的快速能量补充。
葡萄糖加强记忆,刺激钙质吸收和增加细胞间的沟通。但是太多会提高胰岛素的浓度,导致肥胖和糖尿病;太少会造成低血糖症或者更糟,胰岛素休克(糖尿病昏迷)。葡萄糖对脑部功能很重要,葡萄糖的新陈代谢会受下列因素干扰:忧郁、躁郁、厌食和贪食。阿尔兹海默症病人纪录到比其他脑部功能异常更低的葡萄糖浓度,因而造成中风或其他的血管疾病。研究员发现在饮食补充75克的葡萄糖会增加记忆测验的成绩。
葡萄糖被吸收到肝细胞中,会减少肝糖的分泌,导致肌肉和脂肪细胞增加葡萄糖的吸收力。过多的血液葡萄糖会在肝脏和脂肪组织中转换成脂肪酸和甘油三酸脂。
葡萄糖临床应用广泛,用于各种高热、脱水、昏迷或不能进食的患者所需的水分和热量。体内丢失大量体液时,如吐泻、大失血等可先静脉滴注5%~10%葡萄糖和生理盐水以补充水、盐和糖分,并用于低血糖、药物毒物中毒者。静脉滴注25%~50%的高渗溶液,因其高渗压作用,可使组织脱水和短暂利尿,与甘露醇联合交替应用治疗脑水肿、肺水肿及降低眼压。静脉滴注高渗葡萄糖治疗血糖过低。与胰岛素合用,因可促进钾转移入细胞内,也是高钾血症治疗措施之一。
天然的葡萄糖,无论是游离的或是结合的,均属D构型,在水溶液中主要以吡喃式构形含氧环存在,为α和β两种构型的衡态混合物。在常温条件下,可以α-D-葡萄糖的水合物(含1个水分子)形式从过饱和的水溶液中析出晶体,熔点为80℃;而在50~115℃之间析出的晶体则为无水α-D-葡萄糖,熔点146℃。115℃以上析出的稳定形式则为β-D-葡萄糖,熔点为148~150℃。呋喃环形式的葡萄糖仅以结合状态存在于少数天然化合物中。
D-葡萄糖具有一般醛糖的化学性质:在氧化剂作用下,生成葡萄糖酸,葡萄糖二酸或葡萄糖醛酸;在还原剂作用下,生成山梨醇;在弱碱作用下,葡萄糖可与另两种结构相近的六碳糖──果糖和甘露糖──三者之间通过烯醇式相互转化。葡萄糖还可与苯肼结合,生成葡萄糖脎,后者在结晶形状和熔点方面都与其他糖脎不同,可作为鉴定葡萄糖的手段。
大多数生物具有酶系统可分解D-葡萄糖以取得能量的能力。在活细胞中,例如哺乳动物的肌肉细胞或单细胞的酵母细胞中,葡萄糖先后经过不需氧的糖酵解途径、需氧的三羧酸循环以及生物氧化过程生成二氧化碳和水,释放出较多的能量,以ATP(三磷酸腺苷)形式贮存起来,供生长、运动等生命活动之需。在无氧的情况下,葡萄糖仅仅被分解生成乳酸或乙醇,释放出的能量少得多,酿酒是无氧分解的过程。工业上,用酸或酶水解淀粉制得的葡萄糖可用做食品、制酒、制药等工业生产的原料。
2020年版《中国药典》目录二部 1268页
本品为D-(+)-吡喃葡萄糖一水合物。
【
本品在水中易溶,在乙醇中微溶。
【
(2)取干燥失重项下的本品适量,依法测定,本品的红外光吸收图谱应与对照的图谱(光谱集 702图)一致。
【
需氧菌总数、霉菌和酵母菌总数 取供试液1mL,依法检查(通则 1105平皿法),1g供试品中需氧菌总数不得过1000cfu,霉菌和酵母菌总数不得过100cfu。
大肠埃希菌 取1:10的供试液10mL,依法检查(通则 1106),1g供试品中不得检出。
【
【
【
临床上做糖尿病的诊断试验时,通常是测定静脉空腹血糖。当静脉空腹血糖<5.0mmol/L,可排除糖尿病;当静脉空腹血糖>7.0mmol/L并且有临床症状时,则可以诊断为糖尿病;而当静脉空腹血糖在5.5~7.0mmol/L之间并且怀疑糖尿病时,就应该进一步做葡萄糖耐量试验——OGTT。OGTT试验是一种口服葡萄糖负荷试验,用以了解人体对进食葡萄糖后的血糖调节能力。通过OGTT试验,可以早期发现糖代谢异常,早期诊断糖尿病。
葡萄糖糖耐量是指机体对血糖浓度的调节能力。正常人在进食米、面主食或服葡萄糖后,几乎全被肠道吸收,使血糖升高,刺激胰岛素分泌、肝糖原合成增加,分解受抑制,肝糖输出减少,体内组织对葡萄糖利用增加,因此饭后最高血糖不超过10.0mmol/L,且进食或多或少血糖都保持在一个比较稳定的范围内。这说明正常人对葡萄糖有很强的耐受能力,即葡萄糖耐量正常。但若胰岛素分泌不足的人,口服 75g葡萄糖后2小时可超过7.8mmol/L,可等于或大于11.1mmol/L,说明此人对葡萄糖耐量已降低。
通过葡萄糖耐量实验来检测。
方法:口服一定量葡萄糖后,每间隔一定时间测定血糖,利用这一试验可了解胰岛β细胞功能和机体对糖的调节能力。
受检者口服一定量的葡萄糖后,定时测定血中葡萄糖含量,服后若血糖略有升高,两小时内恢复服前浓度为正常;若服后血糖浓度急剧升高,2--3小时内不能恢复服前浓度则为异常。临床上常对症状不明显的病人采用该实验来诊断有无糖代谢异常。
WHO标准化的OGTT:
WHO推荐成人75g葡萄糖,孕妇100g,儿童每公斤体重1.75g,总量≤75g用250ml水溶解,5分钟内口服。服糖前抽空腹血,服糖后每隔30分钟取血,共四次。采血同时每隔1小时留尿测尿糖。根据各次血糖水平绘制糖耐量曲线。
试验前三天每日食物中糖含量应不低于150 g,维持正常活动,影响试验的药物应在三天前停用。整个试验期间不可吸烟、喝咖啡、喝茶或进食。
适用症状:
①无糖尿病症状,随机或空腹血糖异常者;
②无糖尿病症状,有一过性或持续性糖尿;
③无糖尿病症状,但有明显糖尿病家族史;
④有糖尿病症状,但随机或空腹血糖不够诊断标准;
⑤妊娠期、甲状腺功能亢进、肝病、感染,出现糖尿者;
⑥分娩巨大胎儿的妇女或有巨大胎儿史的个体;
1.针剂:每支(瓶)5%(250mL,500mL),10%(500mL),25%(20mL),50%(20mL);
2.注射剂(粉):250g,500g。
可概括为营养、解毒、强心、利尿,它是生理性糖类,也是机体所需能量的主要来源。它在体内被氧化成二氧化化碳和水并同时提供热量,以糖原形式贮存。对肝脏具有保护作用和解毒功能,并能促进毒物的排泄。
口服吸收迅速,进入人体被组织利用,正常人利用葡萄糖能力为6mg/kg。
低渗性脱水患者禁用。
1.有低钾倾向、糖尿病、尿崩症、肾功能不全患者慎用。
2.在使用高浓度糖液过程中,突然停用时,可能引起低血糖。
3.周围静脉滴注高渗葡萄糖易发生静脉炎和血栓,渗漏血管外可刺激局部组织。
4.葡萄糖有吸湿性,且易发霉,故在注射剂的配置和使用过程中,应严格按无菌操作。
5.冬季应先将其加热至与体温相近,再徐徐静注,以避免引起血管痉挛。
(1)胃肠道反应,如恶心、呕吐等,见于口服浓度过高过快时。
(2)反应性低血糖。
用量视病情而定。
葡萄糖在人体新陈代谢中起着重要作用,因此美国药典载有葡萄糖酸钙针剂、片剂、葡萄糖酸钾、葡萄糖酸铁等并在美国大量生产。在食品加工业非常发达的日本,食品添加剂证书上明确记载葡萄糖酸、葡萄糖酸-δ-内酯、葡萄糖酸锌、葡萄糖酸钙、葡萄糖酸亚铁、葡萄糖酸铜可作为食品添加剂,以葡萄糖为原料深加工,除可制造结晶的葡萄糖酸、葡萄糖酸-δ-内酯外,还可制造各种盐,如钾、钠、钙、镁、锌、铁、铜等人体必须的微量元素,人体缺少它,就会发生疾病,如缺铁就会引起贫血,因铁是血红蛋白和肌红蛋白的组织部分,参与氧化和输送二氧化碳,过去硫酸亚铁治疗贫血,人体虽能吸收,但刺激胃肠,会引起一系列不良反应,故改用葡萄糖酸亚铁后,胃肠无明显反应,补铁效果良好,鉴于这种情况,国家规定,用葡萄糖酸的钾、钠、钙、锌、铜、铁、锰等作为人体营养强化剂及药用补充剂,此类药品均有很好的治疗效果。
长期的、科学合理的服用,对一个民族身体素质的提高是不言而喻的,据日本一资料统计,二战后日本青少年的平均身高增长了14.8cm,这与他们在食品、药品制造中科学合理的使用葡萄糖酸微量元素是密不可分的。在中国,大家熟知的葡萄糖酸钙的针剂、片剂和葡萄糖酸锌口服液都具有重要的生理功能、治疗功能,“巨能钙”“补铁口服液”热销全国就是一个充分的验证。
小儿正常生长发育的营养素,以糖、蛋白质及脂肪三大要素为最重要。糖类(碳水化合物)是供应体内热量的主要来源。葡萄糖是一种单糖,进入体内可被直接利用。1~6个月的婴儿,食物中的糖类主要是乳糖和少许淀粉。4个月后含淀粉食物逐渐增加,到1岁时胃肠道消化淀粉的各种酶系统逐渐完善,能迅速将其水解为葡萄糖,并在小肠吸收进入血液。吸收后可直接供给能量,或以糖原形式贮存,过量的可变成脂肪。
人体平时不进食葡萄糖,体内也不会缺乏葡萄糖,因此,平时不需补充。但当小儿在患病、拒食时,体质极度衰弱,为保证小儿基础代谢热量的需要,短时喂以葡萄糖,是可取的,有时静脉输给葡萄糖,就是这个道理。但认为葡萄糖营养价值高,过多过久的给予喂哺,而忽略其他食品供给,可影响小儿食欲,并且由于蛋白质及其它营养素得不到补充,会导致生长迟缓,严重反复感染、营养不良等。还会因血糖升高,引起一过性糖尿,而发生口渴、多饮多尿症状。
小儿消化道产生其他消化酶的腺体被废弃不用,长久会导致萎缩,消化功能更加下降,使之更不能进食其他类食物。正常小儿应尽量让其多吃淀粉类食物,练习咀嚼,以促进唾液腺的分泌,增强食欲及消化功能,并有利于颌面骨及牙齿的发育。
(尚不明确)
⑴静注高渗葡萄糖注射液时应注意药液有无漏出血管外,以免引起静脉炎,在同一部位连续注射5%-10%浓度的药液时也可发生同一并发症。
⑵治疗脑水肿使用高渗溶液时如突然停药,容易发生反跳现象并致使脑水肿再度发生,故不可突然停药,而应缓缓减量直至停用。
⑶不宜做皮下注射,以免引起皮下坏死。
⑷颅内或脊髓膜内出血以及脱水病人谵妄时,均禁止使用高渗葡萄糖注射液,以免发生意外。
高渗葡萄糖、钾和胰岛素(每提供1000大卡热量的葡萄糖需钾30~40mmol)。从营养学角度,对应激状态下的危重病人需要的热能部分应由脂肪乳剂提供并同时供给复合氨基酸制剂。
(一)发酵工业
微生物的生长需要合适的碳氮比,葡萄糖作为微生物的碳源,是发酵培养基的主料,如抗生素、味精、维生素、氨基酸、有机酸、酶制剂等都需大量使用葡萄糖,同时也可用作微生物多聚糖和有机溶剂的原料。
(二)食品工业
目前结晶葡萄糖主要用于食品行业,随着生活水平的提高和食品行业科技的不断发展,葡萄糖在食品行业的应用越来越广泛,今后很长一段时间内食品行业仍是最大的市场。
(三)化学工业
葡萄糖在工业上的应用也很广,在印染制革工业中作还原剂,在制镜工业、热水瓶胆镀银及玻璃纤维镀银等化学镀银工业也常用葡萄糖作还原剂。
葡萄糖在制革工业铬鞣剂制造中的应用:铬鞣剂是制造轻革(鞋面革、服装革)的最好的鞣剂。用铬盐制革已有 100年的历史。所制皮革具有收缩温度高、弹性好、耐挠曲、耐水洗、坚实耐用等特点。铬鞣剂主要是碱式硫酸铬(也可用碱式氯化铬,但其鞣剂效果较硫酸铬差)。其制造方法是以葡萄糖或二氧化硫为还原剂,在硫酸溶液中将重铬酸盐还原成碱式硫酸铬,即制成铬鞣液,鞣液经浓缩、干燥后,可得到粉状铬鞣剂。
(四)合成和转化
葡萄糖可氢化、氧化、异构、碱性降解、酯化、乙缩醛化反应等,合成或转化为其他产品。如氢化制山梨醇;氧化制葡萄糖醛酸、二酸等,并可进一步制成酸钙、酸钠、酸锌以及葡萄糖酸δ内酯;异构化为F42、F55、F90果葡糖浆和结晶果糖;也可异构化为甘露糖(生产甘露糖醇原料),其中山梨醇可进一步生成维生素C,被广泛应用于临床治疗,而且甘露醇15%在临床作为一种安全有效的降低颅内压药物,来治疗脑水肿和青光眼。