-
氰酸 编辑
中文名:氰酸
外文名:cyanicacid
别名:Hocn;Zyansaeure;Chebi:28024
化学式:HCNO
CAS登录号:420-05-3
熔点:-86℃
沸点:23.5℃
水溶性:可溶于水
外观:无色液体或气体
闪点:-32.0±18.7℃
应用:氰酸三聚生成氰尿酸
危险性符号:毒性
分子行输入简码SM:OC#N
国际化学标识码In:1S/CHNO/c2-1-3/h3H
国际化学标识检索码:XLJMAIOERFSOGZ-UHFFFAOYSA-N
H-O-C≡N【正氰酸】、H-N=C=O【异氰酸】、H-O-N=C:【雷酸】之间有区别。他们互为同分异构体。
氰酸有两种指代,有对正氰酸和异氰酸的混合物的指代或者对这两种酸类别上得总称,也有单独对正氰酸的默认指代。氰酸的游离酸是正氰酸与异氰酸二者的混合物,未曾分离开,但其酯类则有两种形式。
正、异氰酸均是有挥发性和腐蚀性的液体,有强烈的醋酸气味 ,密度1.14g/cm3,沸点23.6℃,在水溶液中显示强酸性,性质不稳定,易聚合,水解时生成氨气和二氧化碳。在蒸汽状态或乙醚溶液中游离酸只以异氰酸形式存在。但仅正氰酸与醇类作用时生成氨基甲酸酯。
氰酸可由氰尿酸经加热分解而制得。
维勒测定了氰酸的化学成分,指出它是由碳、氮、氢、氧4种元素组成的。22岁的维勒发表了平生第二篇论文,公布了他所定的氰酸的化学成分。紧接着,维勒又制得了氰酸银和氰酸钾,测定了它们的化学成分。
正氰酸三聚生成氰尿酸(三聚氰酸,即2,4,6-三羟基-1,3,5-三嗪)。
尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应,先分解生成氰酸,并进一步缩合生成三聚氰胺。
6(NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2
正氰酸在浓溶液中聚合成三聚氰酸,又称氰尿酸。(正)氰酸可由三聚氰酸热分解或氰酸钠与盐酸反应来制备。
对应酯类:
正氰酸酯R-O-C≡N 易聚合,并易水解,很难得到纯态物。
异氰酸酯 R-N=C=O或O=C=N-R-N=C=O,一般是带有不愉快气味的液体。
氰酸在水溶液中以正氰酸与异氰酸混合物存在,显示极强酸性。有挥发性和腐蚀性。性质不稳定,易聚合。
有关氰酸的酸性可以参考鲍林酸碱经验规律。在正氰酸中,含有的羟基数目为1,即含有一个羟基氢和一个羟基氧,因此正氰酸属于弱酸。亦可正氰酸视为类卤素来判定。但由于异氰酸在水溶液中会与正氰酸互变。异氰酸中含有一个非羟基氧而大大提高其酸性,从而有效提高了氰酸水溶液的酸性。
雷酸(HONC)属于二元酸,而非一元酸。其原因是雷酸通常以H-O-N=C=C=N-O-H的形式存在,该结构不稳定,易爆炸。由于雷酸(二元)结构中羟基数目为2,不含有非羟基氧,故此雷酸属于弱酸,酸性比醋酸强,比磷酸弱,稍微比亚硝酸强一点。
三聚氰酸为白色结晶。约在330℃解聚为氰酸和异氰酸。从水中析出者含有2分子结晶水,相对密度1.768(0℃),在空气中失去水分而风化;从浓盐酸或硫酸中析出者为无水结晶。1g能溶于约200ml水,无气味,味微苦。该品还以酮式(或异氰尿酸)形式存在。图1中所示的两个结构间来回变换(互变异构)。三羟基的互变异构体通常具有芳香性而会主导。由于芳香结构为三聚氰酸的主要存在形式,与氰酸相比其酸性会大大降低(分子中不含有羟基氧)。
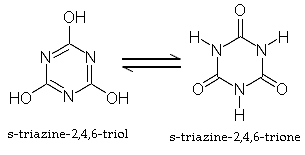 图1
图1
氰酸银和雷酸银是人类发现的第一个同分异构体。
——关于雷酸(HONC)和氰酸(HOCN)
维勒测定了氰酸的化学成分,指出它是由碳、氮、氢、氧4种元素组成的。22岁的维勒发表了平生第二篇论文,公布了他所定的氰酸的化学成分。紧接着,维勒又制得了氰酸银和氰酸钾,测定了它们的化学成分。
就在维勒发表第三篇论文时,格麦林教授提醒他:“请你注意一下德国化学家李比希刚发表的论文!”那时候的李比希,才20岁。维勒赶紧查阅了李比希的论文。奇怪,李比希测定了一种“雷酸”的化学成分,竟跟氰酸差不多!氰酸跟雷酸,化学性质截然不同,氰酸很安定,雷酸很易爆炸。不同的化合物,怎么会具有相同的成分?
不久,维勒来到斯德哥尔摩,来到柏济力阿斯身边。维勒迫不及待地提出了自己的疑问。这时,李比希也看到了维勒关于氰酸的论文。他同样感到疑惑不解。
于是,李比希拿来氰酸银进行分析,发现其中含有氧化银71%,并不象维勒所说的是77.23%。李比希发表论文,认为维勒搞错了。维勒又重做实验,发现李比希搞错了,因为李比希所用的氰酸银不纯净。维勒进一步测定,认为氰酸银所含氧化银应为77.5%。就这样,维勒和李比希展开了热烈的争论。
1826年,李比希发表论文,说他提纯了氰酸银之后,所得结论与维勒一样,同时也与他所测得的雷酸银的化学成分一样。对此,他们无法解释:两种显然不同的化合物,怎么会有相同的成分呢?他们谈起了氰酸、雷酸,雷酸银、氰酸银。经过详尽的讨论,认为双方都没有错。
1830年,柏济力阿斯提出了一个崭新的化学概念,叫做“同分异性”。意思是说,同样的化学成分,可以组成性质不同的化合物。他认为,氰酸与雷酸,便属于“同分异性”,它们的化学成分一样,却是性质不同的化合物。在此之前,化学界一向认为,一种化合物具有一种成分,绝没有两种不同化合物具有同一化学成分。










