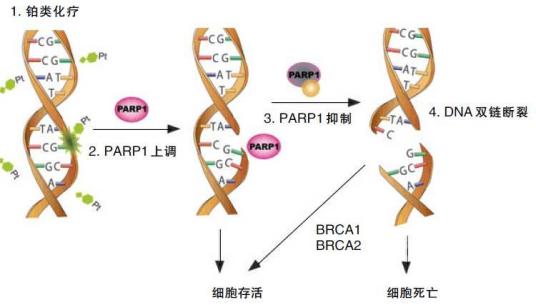
-
PARP 编辑
PARP是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶。它通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器。它还能对许多核蛋白进行聚腺苷二磷酸核糖基化。受它修饰的蛋白质有组蛋白、RNA聚合酶、DNA聚合酶、DNA连接酶等,并通过组蛋白的ADP-核糖基化使组蛋白脱离下来,有助于修复蛋白的结合而进行DNA的损伤修复。同时,PARP又是细胞凋亡核心成员胱天蛋白酶(caspase)的切割底物。因此,它在DNA损伤修复与细胞凋亡中发挥着重要作用。由此可以推断,端锚聚合酶在癌细胞端粒结构的调控机制中有重要作用。端锚聚合酶具有激活后修饰受体蛋白,进而引发一系列的级联反应。同PARP一样,端锚聚合酶很可能也是一个多受体的蛋白质,启动细胞内对端粒结构变化作出反应的信号转导机制,使端粒酶能顺利地将端粒重复片段加到染色体的末端,从而维持癌变细胞端粒结构的稳定。新近研究又发现,除端锚聚合酶与TRF1结合外,TIN2(TRF1-interaCTing nuclear protein 2)也同TRF1结合。TIN2是结合TRF1的一个新的核蛋白。TIN2与TRF1共存于细胞中结合的TRF1、TIN2和端锚聚合酶的丢失,当端粒缩短到一定长度时,产生抑制生长的信号。而在肿瘤细胞中,端粒的缩短可能启动了恢复端粒酶活性的信号途径,从而使端粒保持在一定长度。
在细胞凋亡的研究中,可作为凋亡的标志。
PARP,即poly(ADP-ribose) polymerase,是定位在细胞核内,和应激条件下DNA修复密切相关的一种酶。PARP在体外可以被多种Caspase剪切,在体内是Caspase 3的主要剪切对象。对于人PARP,在Asp124和Gly215之间被Caspase剪切后,使PARP羧基端的催化结构域(89kD)和氨基端的sbDNA结合结构域(24kD)相分离,从而使PARP失去其酶活力。PARP对于细胞的稳定和存活非常重要,PARP失去酶活力会加速细胞的不稳定。
PARP剪切被认为是细胞凋亡的一个重要指标,也通常被认为是Caspase 3激活的指标