-
异种器官移植 编辑
1902年,阿里克西斯·卡雷尔(Alexis Carrel)开创的血管缝合术在为首批异种器官移植开辟了道路,但直到20世纪60年代才取得了实质性进展。那时,外科医生将灵长类动物的器官移植给人类,然而多数手术都在几个月内失败,病人也因此死亡。
1905年,法国的Princeteau进行了世界第一例异种器官移植手术。将兔肾植入肾功能衰竭儿童体内,手术很成功,但16天后由于排异反应,儿童死于肺部感染。之后,世界各地的研究者逐步加入到异种移植器官研究之中。在人体的某些脏器功能失去作用时,移植动物器官能在人体内存活一段时间并能发挥作用,待找到合适的人体器官后再进行移植。用实验动物的组织和器官代替人类的器官有以下优点:动物器官取之不尽;动物器官比人造器官更具自然和生物性;动物器官随用随取,可克服使用人体器官存在的各种伦理及法律问题。
1920年,俄国医生甫洛诺夫(Serge VoroNOff)为了给病人注入青春的活力,将黑猩猩的睾丸切片植入老年男子的阴囊内,10年后,已有数百人接受了这样的手术,女性也接受猩猩卵巢组织移植以治疗更年期症状
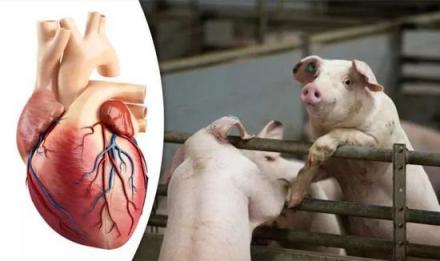
1967年12月3日,人类首次心脏移植手术成功。51年后,科学家成功将猪的心脏移植到狒狒体内,并存活195天。
2008年,患者克劳迪娅-卡斯蒂诺(Claudia Castillo)接受了一个来自死亡捐献者的气管移植器官,研究人员从捐献者体内提取气管,进行大小剪裁,然后放入从克劳迪娅体内提取的干细胞培养环境脚手架中,最终发育形成相应的气管组织。
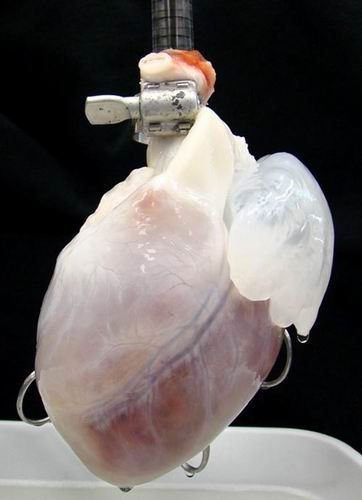
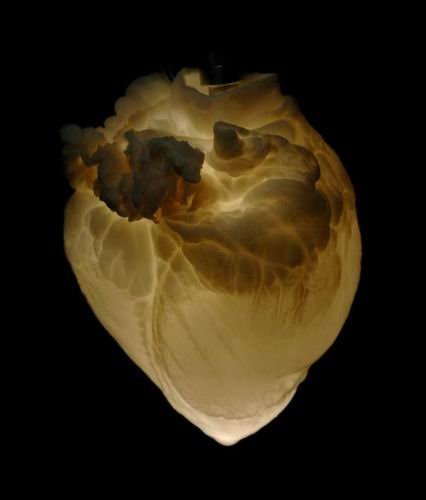
2009年,美国明尼苏达州立大学干细胞科学家桃瑞丝-泰勒(Doris Taylor),在实验室中实现了为新培育的微型心脏连接人造血液供给,人造心脏能够像正常老鼠体内的心脏一样跳动,这种心脏覆盖着一层老鼠心脏去细胞组织的“脚手架”,而且新培育的老鼠心脏组织是基于另一只老鼠的干细胞培育而成。
2015年11月,器官移植已成为许多终末期疾病首选的治疗方法,全世界至今接受心、肝、肾等移植者已达60余万例,随着外科手术的成功,免疫抑制剂的不断发展,移植成功率的提高,出现了供体严重短缺现象,异种移植 已成为研究的方向。只有1/2的患者有机会接受移植,大约有1/5的患者在等待中死亡。
2008年,患者克劳迪娅-卡斯蒂诺重复性地试着培育猪的心脏和肝脏,对于猪器官的培育将更简单一些,因为猪的体型更大,要比处理培育体型较小的老鼠器官更容易。预计去细胞化的移植肝脏器官将比心脏更早地培育出来。
科学家史蒂文-巴迪拉克(Steven Badylak)称,现已研究出如何在老鼠体内培育肝脏去细胞培育法,只是该技术尚未发布。此外,美国马萨诸塞州总医院的研究小组负责人马丁-亚穆什(Martin Yarmush)培育了人造可移植老鼠肝脏器官,从而证明在实验室内可以培育出具备肝功能的移植器官。据该研究小组成员科库特-尤冈(Korkut Uygun)称,研究小组的最终目标是培育出人体去细胞移植器官,并不仅是简单的动物器官。
2009年美国明尼苏达州立大学干细胞科学家桃瑞丝-泰勒(Doris Taylor)的方法非常简单:从人体捐献者或其他动物身体上提取器官,然后用温性洗涤剂去除器官上的肌肉、细胞和DNA,只保留一种叫做“免疫惰性”蛋白质的内部“脚手架”蛋白质,从相关患者体内提取干细胞附加在这个“裸体脚手架”上,来自患者体内的干细胞在培育过程中,会对移植器官起到主体免疫功能,并避免主体遭受由于移植器官导致的新感染。
2018年12月5日,据《自然》最新发布的论文,这个猪心脏移植试验始于2015年,历时3年时间。德国科学家选取了14只幼年猪,将它们的心脏取出进行人源化的基因修饰。14只狒狒被分成3组,科学家用三种不同的方式将猪的心脏移植到狒狒身上。前两组试验中,狒狒接受移植后都没能活过40天。最后一组试验,5只狒狒在接受移植前接受了降血压治疗,因为猪的血压低于狒狒。结果移植心脏生长速度比原有心脏还快,手术后2只狒狒存活3个多月,还有两只分别存活182天和195天。
2022年1月消息,美国医生发表研究称,在脑死亡者体内成功移植两个经基因编辑的猪肾,这表明了在解决全球器官短缺危机方面,异种器官移植可以发挥作用。报道称,2021年9月,50多岁的美国男子吉姆·帕森斯(Jim Parsons)在参加越野车比赛时头部受伤后,后进入脑死亡状态。在其家人的支持下,4天后,美国阿拉巴马大学伯明翰分校的研究人员对他进行了开创性的移植手术。两个猪肾已存活3天以上。
2022年3月8日在存活约两个月后,接受全球首例猪心脏移植手术的患者戴维·贝内特于去世。 研究证实,可能有多种原因叠加导致了患者的心力衰竭。
桃瑞丝这种培育的复杂器官面临的较大挑战是如何确保所有的器官内细胞与患者的血液相溶合,如果没有血液进入,移植器官中心的细胞则会严重缺氧,导致移植后细胞死亡。桃瑞丝称,她有办法能够克服这种困难。2008年1月,她带领的一支研究小组实现了较大的技术突破,他们基于新生老鼠心脏细胞培育出一个跳动中的心脏,这个心脏保持着3D外形,其内部充满着所有血管。当他们植入一些新的细胞,会生长出血管组织。此外,桃瑞丝表示他们几乎能够重新培育出带有细胞的完整血管系统,其中包括动脉、静脉和毛细血管。她说:“由于我们培育出了血管,新的移植器官能够与患者身体的血液供给系统自然地连接在一起。”在移植心脏器官的培育过程中,干细胞转换成为心室和心房的内皮细胞,还可形成血管和心脏平滑肌细胞。
匹兹堡大学医学院的大卫-库珀(DAvid Cooper)是异种器官移植技术的主要研发人员,他指出,“裸体”猪心脏仍携带着alpha-Gal抗原体,人体免疫系统能够识别,并遭受其攻击。但是伦敦大学学院再生医学教授克莉丝-梅森(Chris Mason)指出,许多培育的去细胞猪器官都没有施用辅助免疫药物,必须对猪器官内对人体免疫系统构成攻击的物质彻底消除,否则未来数百万名患者一旦接受猪心脏移植后将出现心脏瓣膜和相关组织的副作用。
成为培育人类移植心脏“脚手架”
动物器官异种移植排异过程在某些方面与同种排斥相似,可以借鉴。但异种移植又有其特性:细胞表面存在更多的“异物”,会与宿主产生强烈的反应,这种跨物种间的移植存在较大的分子差异,包括天然抗体、补体、NK细胞和巨噬细胞等。常出现的超急性排异反应(HAR),排异反应在血液循环后几分钟或数小时发生,也可在24-48小时内发生不可逆转体液排斥反应,较常见的发生在手术台上;急性血管性排斥反应(AVR),血管化脏器移植后数天到数周间发生,也是不可逆转性体液排斥反应,常发生在手术后早期,病情进展迅速;加速性细胞排斥反应(TMR),受者循环血液中存在抗供者抗体并不一定引起HAR和AVR的情况下,可能出现加速性细胞排斥反应。该反应对免疫抑制剂抑制效果不良。受者抗供者抗体的存在可促进抗体依赖性细胞介导的细胞毒作用,促使发生细胞性排斥反应,病理表现以间质水肿和局限性炎性细胞浸润为特征,细胞浸润的局部毛细血管内皮细胞变性和坏死。异种移植的免疫障碍也远远大于同种移植(Allografts)。异种器官移植排斥反应类型
依据供、受者种族遗传背景差异程度分为协调性(Concordant)和非协调性(Discordant)。协调性异种移植发生在种属较近的动物之间,如大鼠与小鼠之间;非协调性异种移植则在种系发生较远的种属间进行,排斥以分钟或小时计,常导致HAR发生,如猪器官移植到人、豚鼠与大鼠之间的移植。有学者将协调性异种移植分为困难型和容易型;依据排斥反应发生机理将非协调性异种移植分为抗体型和非抗体型两类。所不同的是在协调性异种移植中是诱生抗体,而在非协调性移植中则是预存天然抗体。
科学家尚未发现该病毒对猪有害,受感染的实验鼠也未患上疾病。但是,人体被该病毒感染后会产生什么后果,还不得而知。不同动物体内有不同的微生物群,对一种动物无害的病毒,在另一种动物身上可能造成严重危害,这并非没有先例。1997年,英国伦敦大学学院的罗宾·韦斯等就曾报告说,他们在猪体内发现了两种新型病毒。这两种病毒不仅不损害猪的健康,而且一定程度上还能增强猪的机体功能。然而它们却能使猴子、猫和某些鸟类患上白血病。从其结构推断,科学家认为它们也可能会让人类患上白血病。
科学家担心,人类对猪体内的各种病毒还了解得太少,将猪器官移植给人存在风险,甚至有可能引发新型大规模传染病,产生不堪设想的后果。
尽管病毒问题给异种器官移植的前景投下重重阴影,许多科学家仍赞成继续这类研究。他们指出,异种器官移植具有极大医疗潜力,不应半途而废。科学家们呼吁深入研究猪体内的病毒并寻求相应的对付方法,同时对移植试验进行严格的审查与控制。