-
双原子分子 编辑
同核双原子分子
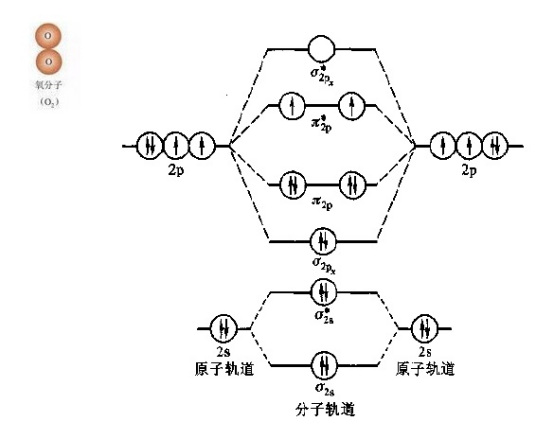
很多非金属元素(包括氢、氮、氧、氟、氯、溴、碘<当一个非金属元素不能当成是一种物质时,这个非金属元素组成的单质是双原子分子>等)的单质均是双原子分子。其他元素(如磷)也可能以双原子分子构成单质,但这些双原子分子并不稳定。这些构成单质的双原子分子称为同核双原子分子。其中,氮和氧的同核双原子分子占地球大气层成份的 99%。
异核双原子分子
以双原子分子存在的化合物包括一氧化碳、一氧化氮等。这些双原子分子称为异核双原子分子。
准双原子分子
分子中的原子之间有相互作用力。不是所有的原子在通常情况下都能形成稳定的分子,例如氯原子与氙原子,只有当它们处于激发态时,才有可能形成氯化氙,回到基态又分裂为单个原子,这种分子叫准分子,利用准分子的特性可制成准分子激光器。
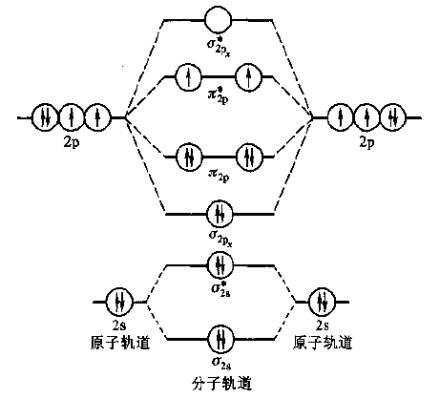
同核双原子分子的分子轨道能级图
将分子轨道按能量由低到髙排列,可得到分子轨道能级图。第二周期同核双原子分子轨道能级图(图1)有两种情况。图1

双原子分子图册
分子轨道的能量,主要是从电子吸收光谱、光电子能谱(PES)或相关计算来确定的。
在分子轨道理论中,分子中全部电子属于分子所有,电子进人成键分子轨道使系统能量降低,对成键有贡献,电子进人反键分子轨道使系统能量升高,对成键起削弱或抵消作用。总之,成键轨道中电子多、分子稳定,反键轨道中电子多,分子不稳定。分子的稳定性通过键级来描述,键级愈大,分子愈稳定。分子轨道理论把分子中成键电子和反键电子数的一半定义为键级。键级=
异核双原子分子的分子轨道能级图
(2)CO 一氧化碳也是一种异核双原子分子,它的核外电子总数等于14,与氮气的分子轨道有相似之处。见图4。
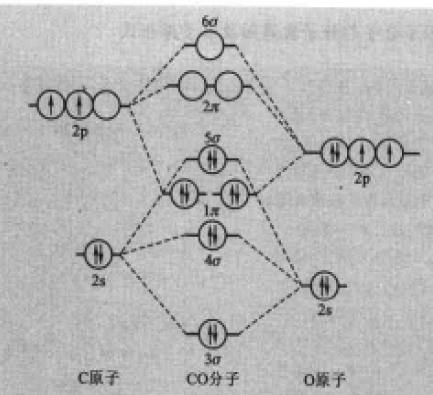 图4CO的分子轨道能级图
图4CO的分子轨道能级图
同核双原子分子分子轨道电子排布式
(1)
(2)
(3)
(4)
其电子排布式为:
最后2 个电子进入
异核双原子分子分子轨道电子排布式
(1)HF 氢原子和氟原子共有10个电子,根据最低能量原理和pauli不相容原理,把这些电子填入分子轨道中,可知使HF分子能量降低的是进入
(2)CO CO的核外电子总数为14,电子构型为
根据电子排布规则,最高占有分子轨道(HOMO)是最后被占据的分子轨道,最低未占分子轨道(LUMO)是紧接其后的能量较高的空分子轨道,两者一起构成分子的前线轨道。前线轨道的这种组合方式非常重要,这是d区元素容易形成羰基化合物的原因之一,金属羰基化合物中的HOMO含电子轨道参与形成