-
EGFR 编辑
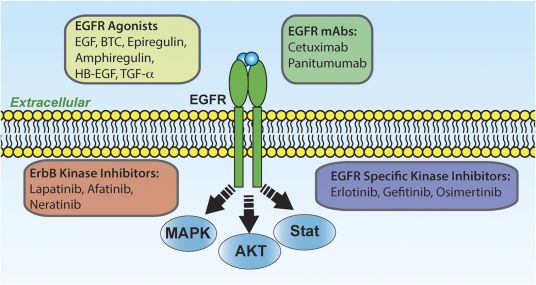
EGFR(Epidermal Growth Factor Receptor)是上皮生长因子(EGF)细胞增殖和信号传导的受体。EGFR属于ErbB受体家族的一种,该家族包括EGFR (ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3) 和Her 4(ErbB-4)。EGFR也被称作HER1、ErbB1,突变或过表达一般会引发肿瘤。EGFR是一种糖蛋白,属于酪氨酸激酶型受体,细胞膜贯通,分子量170KDA。EGFR位于细胞膜表面,靠与配体结合来激活,包括EGF和TGFα(transforming growth factor α)。激活后,EGFR由单体转化为二聚体,尽管也有证据表明,激活前也存在二聚体。EGFR还可能和ErbB受体家族的其他成员聚合来激活,例如ErbB2/Her2/neu。
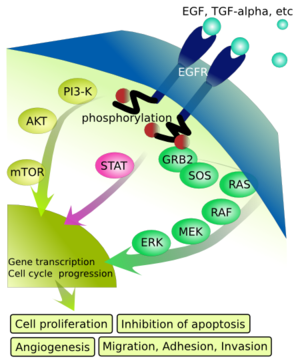
EGFR二聚后可以激活它位于细胞内的激酶通路,包括Y992, Y1045, Y1068, Y1148 and Y1173等激活位点。 这个自磷酸化可以引导下游的磷酸化,包括MAPK,Akt和JNK通路, 诱导细胞增殖。受体激活对于皮肤的免疫来说很重要。
研究表明在许多实体肿瘤中存在EGFR的高表达或异常表达。EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。其可能机制有:EGFR的高表达引起下游信号传导的增强;突变型EGFR受体或配体表达的增加导致EGFR的持续活化;自分泌环的作用增强;受体下调机制的破坏;异常信号传导通路的激活等。EGFR的过表达在恶性肿瘤的演进中起重要作用,胶质细胞、肾癌、肺癌、前列腺癌、胰腺癌、乳腺癌等组织中都有EGFR的过表达。对胶质细胞瘤的研究发现EGFR的高表达主要与其基因扩增有关。但有时EGFR表达水平的调节异常也存在于翻译及翻译后。EGFR在肿瘤中的高表达还可能与活化后降解减少有关,一些研究指出c-Src可通过抑制受体泛素化和内吞作用而上调EGFR水平。许多肿瘤中有突变型EGFR存在,现已发现许多种EGFR突变型。突变型EGFR的作用可能包括:具有配体非依赖型受体的细胞持续活化;由于EGFR的某些结构域缺失而导致受体下调机制的破坏、异常信号传导通路的激活、细胞凋亡的抑制等。突变体的产生是由于EGFR基因的缺失、突变和重排。EGFR的配体对细胞内信号传导有很大影响。EGFR的配体通过自分泌形式激活EGFR促进细胞增殖,他们的共表达往往预示肿瘤预后不良,例如,在乳腺浸润性导管癌的研究中发现,TGFα与EGFR共表达,且这种共表达与病人的生存率显著相关。Kopp等人对结/直肠癌的研究表明肿瘤的自分泌生长是EGFR的过表达及其配体表达共同作用的结果。
此外,对EGFR与肿瘤的血管生成、高侵袭性及转移关系的研究发现EGFR可以通过Ang-1及VEGF等因子水平的调节而影响肿瘤血管生成。
在配体与表皮生长因子受体(EGFR)结合后,受体发生了二聚作用,二聚作用既包括两个同种受体分子的结合(同源性二聚作用),也包括人类EGF相关性受体(HER)酪氨酸激酶家族中的不同成员的结合(异源性二聚作用)。 二聚作用后是酪氨酸残基的自磷酸化作用。这些磷酸化的残基是募集适配蛋白和额外的酪氨酸激酶底物的结合位点。蛋白质在激活的受体复合物中相互作用刺激ras蛋白,导致磷酸化级联反应的发生和丝裂原激活蛋白(MAP)激酶的激活。或者转录信号传导和激活、磷脂酰肌醇激酶-3(PI3K)-Akt和应激活化蛋白激酶(SAPK)信号传导通路将被激活。这些信号通路依次触发基因转录,同时控制细胞增生、分化和生存的通路被激活。
EGFR信号通路有多重的生物学作用。例如,ras-MAPK信号转导通路刺激细胞的分裂和迁徙。EGFR也是多种受体通路的重要介体,起到信号会聚点的作用,能够将信号整和与多样化。例如,在应激、膜解聚作用和一些非生理性刺激物(包括氧化剂、放射线和烷化剂)的反应中,反向激活能诱导EGFR酪氨酸激酶的磷酸化并随后发生信号的转导。EGFR家族的成员在正常发育中起了重要的作用,但在人类肿瘤中经常过度表达并失去控制。
EGFR和KRAS基因检测
EGFR表达于正常上皮细胞表面,而在一些肿瘤细胞中常过表达,EGFR的过表达和肿瘤细胞的转移、侵润、预后差有关。EGFR下游的信号转导通路主要有两条:一条是Ras/ Raf/ MEK/ERK-MAPK 通路,而另一条是PI3K/Akt/mTOR通路。
EGFR突变:EGFR酪氨酸激酶区域的突变主要发生在18-21外显子,其中19和21号外显子突变覆盖突变的 90%。
KRAS基因检测
KRAS蛋白处于EGFR信号通路通路的下游。在正常生理情况下,EGFR信号通路被活化后,KRAS蛋白短暂激活,其后迅速失活,KRAS激活/失活效应是受控的。而KRAS基因突变时,可以导致EGFR信号通路持续激活,加速肿瘤细胞增殖。KRAS基因突变96%发生在第2号外显子的12、13号密码子。20% 非小细胞肺癌(NSCLC)、30-35%大肠癌患者中存在KRAS基因突变。
KRAS基因检测的重要性
K-ras基因可以是正常状态(称为野生型)或异常状态(突变型)。 K-ras突变型编码异常的蛋白,刺激促进恶性肿瘤细胞的 生长和扩散;并且不受上游EGFR的信号影响,所以对抗EGFR治疗效果差。KRAS基因检测可以筛选出EGFR靶向治疗药物有效的大肠癌患者,帮助医生选择对肿瘤病人最有效的治疗方法,实现肿瘤病人的个体化治疗。目前在欧美国家,大肠癌患者内科治疗前已经常规检测KRAS状态,并且成为能否报销相关抗EGFR治疗费用的凭据。
K-ras基因突变发生的时间 K-ras基因突变发生在肿瘤恶变的早期,并且原发灶和转移灶的K-ras基因高度保持一致。一般认为,K-ras基因状态不会因治疗而发生变化。大肠癌患者K-ras基因突变异常的概率为30%-35%。