-
累积稳定常数 编辑
配位化合物为一类具有特征化学结构的化合物,由中心原子(或离子,统称中心原子)和围绕它的分子或离子(称为配位体/配体)完全或部分通过配位键结合而形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物。研究配合物的化学分支称为配位化学。
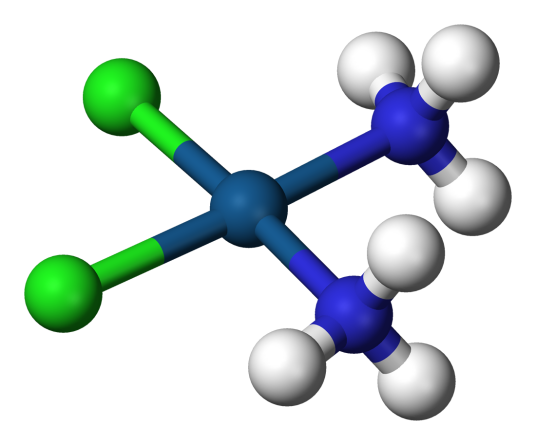
例如,K4、SO4、和都是配合物。
通常,配位化合物的稳定性主要指热稳定性和配合物在溶液中是否容易电离出其组分(中心原子和配位体)。配位本体在溶液中可以微弱地离解出极少量的中心原子(离子)和配位体,例如〔Cu(NH3)4〕2+可以离解出少量的Cu2+和NH3:
配位本体在溶液中的离解平衡与弱电解质的电离平衡很相似,也有其离解平衡常数,称为配合物的稳定常数K。
K越大,配合物越稳定,即在水溶液中离解程度小。
配合物在溶液中的稳定性与中心原子的半径、电荷及其在周期表中的位置有关,也就是该配合物的离子势:φ=Z/r φ为离子势 Z为电荷数 r为半径。过渡金属的核电荷高,半径小,有空的d轨道和自由的d电子,它们容易接受配位体的电子对,又容易将d电子反馈给配位体。因此,它们都能形成稳定的配合物。碱金属和碱土金属恰好与过渡金属相反,它们的极化性低,具有惰性气体结构,形成配合物的能力较差,它们的配合物的稳定性也差。
配合物的稳定性符合软硬亲和理论,即软亲软、硬亲硬。
设MLn型配合物在溶液中存在下列平衡,则可用逐级稳定常数(stepwise stability constant)Kn来表示各级的平衡状况 :

为书写简便起见,在配位平衡中常常略去离子的电荷。例如分别以下面的符号表示括号内的离子:H(H+)、OH(OH-)、M(Mn+)、L(Lm-)、ML((ML)n-m)等。
在实际计算中采用累计稳定常数更为方便。累计稳定常数(cumulative stability constant)β定义为
K和β均为浓度常数,与温度和离子强度有关。因为这些数值较大,常用指数或对数形式表示,根据lgβi值,不难求出各级稳定常数Ki。
金属离子Mn+和配位体A-生成配离子MAx(n-x)+,在水溶液中存在如下平衡:
根据平衡移动原理,改变Mn+或A-的浓度,会使上述平衡发生移动。若在上述溶液中加入某种试剂使Mn+生成难溶化合物,或者改变Mn+的氧化状态,都会使平衡向左移动。若改变溶液的酸度使A-生成难离解的弱酸,也可使平衡向左移动。
配合平衡同样是一种相对的平衡状态,它同溶液的PH值、沉淀反应、氧化还原反应等都有密切的关系。
(一)与酸度的关系
根据酸碱质子理论,所有的配位体都可以看作是一种碱。因此,在增加溶液中的H+浓度时,由于配位体同H+结合成弱酸面使配合平衡向右移动,配离子平衡遭到破坏,这种现象称为酸效应,例如:
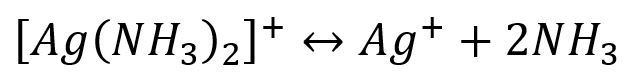
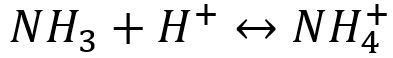
配位体的碱性愈强,溶液的PH值愈小,配离子愈易被破坏。
金属离子在水中,都会有不同程度的水解作用。溶液的PH值愈大,愈有利于水解的进行。例如:Fe3+在碱性介质中容易发生水解反应,溶液的碱性愈强,水解愈彻底(生成Fe(OH)3沉淀)。
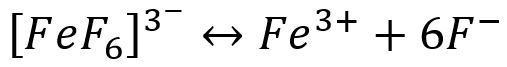

因此,在碱性介质中,由于Fe3+水解成难溶的Fe(OH)3沉淀而使平衡向右移动,因而3-遭到破坏,这种现象称为金属离子的水解效应。
(二)与沉淀反应的关系
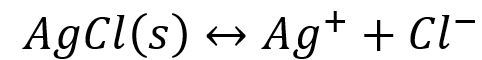

当在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成。
由于AgBr的溶解度比AgCL的溶解度小得多,因而Br-争夺Ag+的能力比CL-的大,所以能产生AgBr沉淀而不能产生AgCL沉淀。沉淀剂与金属离子生成沉淀的溶解度愈小,愈能使配离子破坏而生成沉淀。
(三)与氧化还原反应的关系
配合反应的发生可以改变金属离子的氧化能力。例如:当PbO2与盐酸反应时,其产物不是PbCL4,而是PbCL2和CL2。但是当它形成2-配离子后,Pb就能保持它的+4氧化态。
配合反应影响氧化还原反应的方向。例如,Fe3+可以把I-氧化成I2:
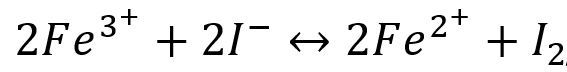
在加入F-后,由于生成3-,减少了Fe3+的浓度,使平衡向左移动。
当我们考查配合反应对氧化还原反应的影响时,不仅要注意配离子的形成,而且还要注意配离子的稳定性。