-
轻链 编辑
轻链(light chain,L)大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。每条轻链含有两个由链内二硫键内二硫所组成的环肽。L链共有两型:kappa(κ)与lambda(λ),同一个天然免疫球蛋白分子上L链的型总是相同的。正常人血清中的κ:λ约为2:1。游离轻链的测定及其医学意义:
免疫球蛋白(Ig)轻链分为κ(kappa)和λ(lambda)2个型别,每个Ig分子上只有一个型别的轻链,人类κ(kappa)和λ(lambda)的比例为6:4.轻链为能自由通过肾小球基底膜的小分子蛋白质,在肾小管被重吸收回到血循环中,所以正常人尿中只有少量轻链存在。当代谢失调和多发性骨髓瘤时,血中出现大量游离轻链,并由尿中排出,即为Bence-Jones蛋白(本周蛋白)。
轻链为免疫球蛋白分子中相对分子量较小的链。免疫球蛋白分子的基本结构是由二硫键连接的四条多肽链组成的对称结构,称为单体,呈“Y”或“T”字形。其中两条相同的长链,由450 ~550个氨基酸残基组成,相对分子量较大,称为重链。另两条相同的短链,由214个氨基酸残基组成,相对分子量较小,称为轻链。每条多肽链都有氮基端和基端,氨基末端轻链的1/2和重链的1/4区域内氨基酸组成及排列顺序高度可变,称为可变区(V区),用VH和VL表示,能与抗原特异性结合。羧基末端轻链的1/2与重链的3/4区域内氨基酸的组成和排列比较恒定,称此区为恒定区,用CH 和CL.表示。位于重链恒定区之间的铰链区,含有大量的脯酸,富有弹性,可使免疫球蛋白由T型转变为Y型,暴露补体结合点,便于结合补体。
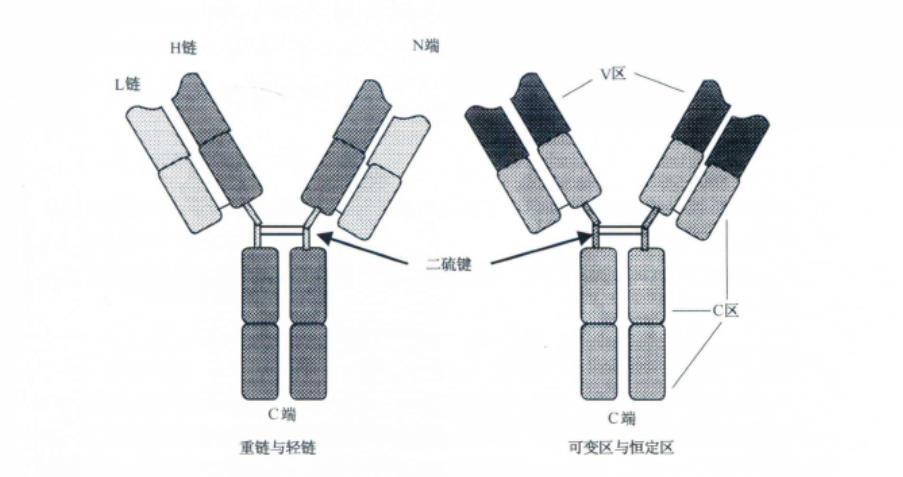 免疫球蛋白基本结构
免疫球蛋白基本结构










