-
细胞凋亡 编辑
中文名:细胞凋亡
外文名:Apoptosis
人体内的细胞注定是要死亡的,有些死亡是生理性的,有些死亡则是病理性的,有关细胞死亡过程的研究,已成为生物学、医学研究的一个热点。人们已经知道细胞的死亡起码有两种方式,即细胞坏死与细胞凋亡(apoptosis)。细胞坏死是早已被认识到的一种细胞死亡方式,而细胞凋亡则是逐渐被认识的一种细胞死亡方式。
细胞凋亡是细胞的一种基本生物学现象,在多细胞生物去除不需要的或异常的细胞中起着必要的作用。它在生物体的进化、内环境的稳定以及多个系统的发育中起着重要的作用。细胞凋亡不仅是一种特殊的细胞死亡类型,而且具有重要的生物学意义及复杂的分子生物学机制。
凋亡是多基因严格控制的过程。这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P35等,随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识,但是迄今为止凋亡过程确切机制尚不完全清楚。而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系。如肿瘤、自身免疫性疾病等,能够诱发细胞凋亡的因素很多,如射线、药物等。
1. 凋亡概念的形成 1965年澳大利亚科学家发现,结扎鼠门静脉后,电镜观察到肝实质组织中有一些散在的死亡细胞,这些细胞的溶酶体并未被破坏,显然不同于细胞坏死。这些细胞体积收缩、染色质凝集,从其周围的组织中脱落并被吞噬,机体无炎症反应。1972年Kerr等三位科学家首次提出了细胞凋亡的概念,宣告了对细胞凋亡的真正探索的开始,在此之前,关于胚胎发育生物学、免疫系统的研究,肝细胞死亡的研究都为这一概念的提出奠定了基础。
2.细胞凋亡的形态学及生物化学研究阶段(1972-1987)。
1)利用光镜和电镜对形态学特征进行了详细的研究。
2)染色体DNA的降解:细胞凋亡的一个显著特征就是细胞染色质的DNA降解,凋亡时DNA的断片大小规律是200bp的整数倍。
4)钙离子变化,细胞内钙离子浓度的升高是细胞发生凋亡的一个重要条件。
5)内源性核酸内切酶:细胞发生凋亡是需要这种核酸内切酶参与的。
3.细胞凋亡的分子生物学研究阶段。
1)与细胞凋亡的相关基因及调控。
2)细胞凋亡的信号转导。
3)与细胞凋亡的各种分子及其相互作用及相互关系。
细胞凋亡与程序性死亡
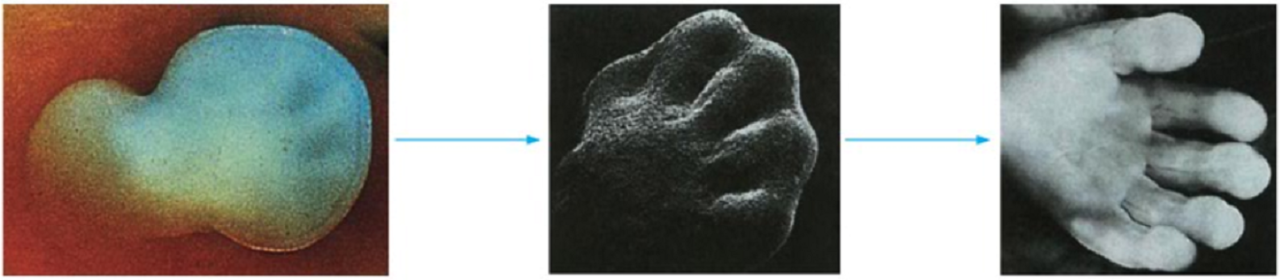
其实从严格的词学意义上来说,细胞程序性死亡(PCD)与细胞凋亡是有很大区别的。细胞程序性死亡的概念是1956年提出的,PCD是个功能性概念,描述在一个多细胞生物体中某些细胞死亡是个体发育中的一个预定的,并受到严格程序控制的正常组成部分。例如蝌蚪变成青蛙,其变态过程中尾部的消失伴随大量细胞死亡,高等哺乳类动物指间蹼的消失、颚融合、视网膜发育以及免疫系统的正常发育都必须有细胞死亡的参与。这些形形色色的在机体发育过程中出现的细胞死亡有一个共同特征:即散在的、逐个地从正常组织中死亡和消失,机体无炎症反应,而且对整个机体的发育是有利和必须的。因此认为动物发育过程中存在的细胞程序性死亡是一个发育学概念,而细胞凋亡则是一个形态学的概念,描述一件有着一整套形态学特征的与坏死完全不同的细胞死亡形式。但是一般认为凋亡和程序性死亡两个概念可以交互使用,具有同等意义。
 胎儿手的发育过程
胎儿手的发育过程
细胞凋亡与坏死的区别
虽然凋亡与坏死的最终结果极为相似,但它们的过程与表现却有很大差别。
坏死(necrosis):坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。表现为细胞 胀大,胞膜破裂,细胞内容物外溢,核变化较慢,DNA降解不充分,引起局部严重的炎症反应。
凋亡是细胞对环境的生理性病理性刺激信号,环境条件的变化或缓和性损伤产生的应答有序变化的死亡过程。其细胞及组织的变化与坏死有明显的不同。
过程
1、凋亡起始
2、凋亡小体形成
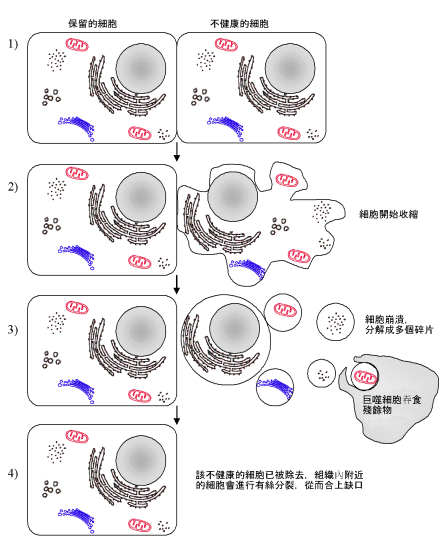
3、凋亡小体逐渐被邻近的细胞或体内吞噬细胞所吞噬,凋亡细胞的残余物质被消化后重新利用。
形态学变化
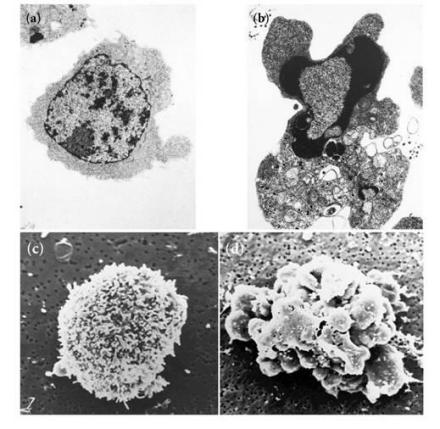
形态学观察细胞凋亡的变化是多阶段的,细胞凋亡往往涉及单个细胞,即便是一小部分细胞也是非同步发生的。首先出现的是细胞体积缩小,连接消失,与周围的细胞脱离,然后是细胞质密度增加,线粒体膜电位消失,通透性改变,释放细胞色素C到胞浆,核质浓缩,核膜核仁破碎,DNA降解成为约180bp-200bp片段;胞膜有小泡状形成,膜内侧磷脂酰丝氨酸外翻到膜表面,胞膜结构仍然完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体,无内容物外溢,因此不引起周围的炎症反应,凋亡小体可迅速被周围专职或非专职吞噬细胞吞噬。
生物化学变化
1)DNA的片段化
细胞凋亡的一个显著特点是细胞染色体的DNA降解,这是一个较普遍的现象。这种降解非常特异并有规律,所产生的不同长度的DNA片段约为180-200bp的整倍数,而这正好是缠绕组蛋白寡聚体的长度,提示染色体DNA恰好是在核小体与核小体的连接部位被切断,产生不同长度的寡聚核小体片段,实验证明,这种DNA的有控降解是一种内源性核酸内切酶作用的结果,该酶在核小体连接部位切断染色体DNA,这种降解表现在琼脂糖凝胶电泳中就呈现特异的梯状Ladder图谱,而坏死呈弥漫的连续图谱。2) 大分子合成
细胞凋亡的生化改变不仅仅是DNA的有控降解,在细胞凋亡的过程中往往还有新的基因的表达和某些生物大分子的合成作为调控因子。如我们实验室发现的TFAR-19就是在细胞凋亡时高表达一种分子,再如在糖皮质激素诱导鼠胸腺细胞凋亡过程中,加入RNA合成抑制剂或蛋白质合成抑制剂即能抑制细胞凋亡的发生。
细胞凋亡的过程大致可分为以下几个阶段:
接受凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶的活化(Caspase)→进入连续反应过程
启动阶段
细胞凋亡的启动是细胞在感受到相应的信号刺激后胞内一系列控制开关的开启或关闭,不同的外界因素启动凋亡的方式不同,所引起的信号转导也不相同,客观上说对细胞凋亡过程中信号传递系统的认识还是不全面的,比较清楚的通路主要有:
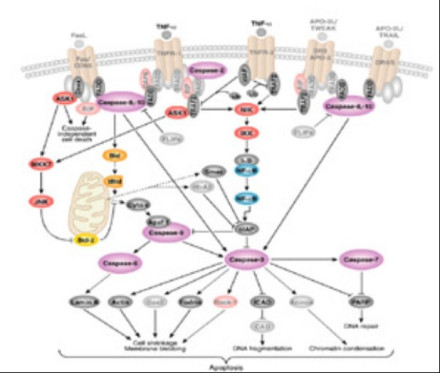
1)细胞凋亡的膜受体通路:各种外界因素是细胞凋亡的启动剂,它们可以通过不同的信号传递系统传递凋亡信号,引起细胞凋亡,我们以Fas -FasL为例:
Fas是一种跨膜蛋白,属于肿瘤坏死因子受体超家族成员,它与FasL结合可以启动凋亡信号的转导引起细胞凋亡。它的活化包括一系列步骤:首先配体诱导受体三聚体化,然后在细胞膜上形成凋亡诱导复合物,这个复合物中包括带有死亡结构域的Fas相关蛋白FADD。Fas又称CD95,是由325个氨基酸组成的受体分子,Fas一旦和配体FasL结合,可通过Fas分子启动致死性信号转导,最终引起细胞一系列特征性变化,使细胞死亡。Fas作为一种普遍表达的受体分子,可出现于多种细胞表面,但FasL的表达却有其特点,通常只出现于活化的T细胞和NK细胞,因而已被活化的杀伤性免疫细胞,往往能够最有效地以凋亡途径置靶细胞于死地。Fas分子胞内段带有特殊的死亡结构域(DD,death domain)。三聚化的Fas和FasL结合后,使三个Fas分子的死亡结构域相聚成簇,吸引了胞浆中另一种带有相同死亡结构域的蛋白FADD。FADD是死亡信号转录中的一个连接蛋白,它由两部分组成:C端(DD结构域)和N端(DED)部分。DD结构域负责和Fas分子胞内段上的DD结构域结合,该蛋白再以DED连接另一个带有DED的后续成分,由此引起N段DED随即与无活性的半胱氨酸蛋白酶8(caspase8)酶原发生同嗜性交联,聚合多个caspase8的分子,caspase8分子遂由单链酶原转成有活性的双链蛋白,进而引起随后的级联反应,即Caspases,后者作为酶原而被激活,引起下面的级联反应。细胞发生凋亡。因而TNF诱导的细胞凋亡途径与此类似
2)细胞色素C释放和Caspases激活的生物化学途径
线粒体是细胞生命活动控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡调控中心。实验表明了细胞色素C从线粒体释放是细胞凋亡的关键步骤。释放到细胞浆的细胞色素C在DATP存在的条件下能与凋亡相关因子1(Apaf-1)结合,使其形成多聚体,并促使caspase-9与其结合形成凋亡小体,caspase-9被激活,被激活的caspase-9能激活其它的caspase如caspase-3等,从而诱导细胞凋亡。此外,线粒体还释放凋亡诱导因子,如AIF,参与激活caspase。可见,细胞凋亡小体的相关组份存在于正常细胞的不同部位。促凋亡因子能诱导细胞色素C释放和凋亡小体的形成。很显然,细胞色素C从线粒体释放的调节是细胞凋亡分子机理研究的关键问题。多数凋亡刺激因子通过线粒体激活细胞凋亡途经。有人认为受体介导的凋亡途经也有细胞色素C从线粒体的释放。如对Fas应答的细胞中,一类细胞(type1)中含有足够的胱解酶8 (caspase8)可被死亡受体活化从而导致细胞凋亡。在这类细胞中高表达Bcl-2并不能抑制Fas诱导的细胞凋亡。在另一类细胞(type2)如肝细胞中,Fas受体介导的胱解酶8活化不能达到很高的水平。因此这类细胞中的凋亡信号需要借助凋亡的线粒体途经来放大,而Bid -- 一种仅含有BH3结构域的Bcl-2家族蛋白是将凋亡信号从胱解酶8向线粒体传递的信使。
执行
尽管凋亡过程的详细机制尚不完全清楚,但是已经确定Caspase即半胱天冬蛋白酶在凋亡过程中是起着必不可少的作用,细胞凋亡的过程实际上是Caspase不可逆有限水解底物的级联放大反应过程,到目前为止,至少已有14种Caspase被发现,Caspase分子间的同源性很高,结构相似,都是半胱氨酸家族蛋白酶,根据功能可把Caspase基本分为二类:一类参与细胞的加工,如Pro-IL-1β和Pro-IL-1δ,形成有活性的IL-1β和IL-1δ;第二类参与细胞凋亡,包括caspase2,3,6,7,8,9.10。Caspase家族一般具有以下特征:
1)C端同源区存在半胱氨酸激活位点,此激活位点结构域为QACR/QG。
2)通常以酶原的形式存在,相对分子质量29000-49000(29-49KD),在受到激活后其内部保守的天冬氨酸残基经水解形成大(P20)小(P10)两个亚单位,并进而形成两两组成的有活性的四聚体,其中,每个P20/P10异二聚体可来源于同一前体分子也可来源于两个不同的前体分子。
3)末端具有一个小的或大的原结构域。
参与诱导凋亡的Caspase分成两大类:启动酶(inititaor)和效应酶(effeCTor)它们分别在死亡信号转导的上游和下游发挥作用。
Caspase的活化是有顺序的多步水解的过程,Caspase分子各异,但是它们活化的过程相似。首先在caspase前体的N-端前肽和大亚基之间的特定位点被水解去除N-端前肽,然后再在大小亚基之间切割释放大小亚基,由大亚基和小亚基组成异源二聚体,再由两个二聚体形成有活性的四聚体。去除N-端前肽是Caspase的活化的第一步,也是必须的,但是Caspase-9的活化不需要去除N-端前肽,Caspase活化基本有两种机制,即同源活化和异源活化,这两种活化方式密切相关,一般来说后者是前者的结果,发生同源活化的Caspase又被称为启动caspase(initiator caspase),包括caspase-8,-10,-9,诱导凋亡后,起始Caspase通过adaptor被募集到特定的起始活化复合体,形成同源二聚体构像改变,导致同源分子之间的酶切而自身活化,通常caspase-8,10,2介导死亡受体通路的细胞凋亡,分别被募集到Fas和TNFR1死亡受体复合物,而Caspase-9参与线粒体通路的细胞凋亡,则被募集到Cyt c/d ATP/Apaf-1组成的凋亡体(apoptosome)。同源活化是细胞凋亡过程中最早发生的capases水解活化事件,启动Caspase活化后,即开启细胞内的死亡程序,通过异源活化方式水解下游Caspase将凋亡信号放大,同时将死亡信号向下传递。异源活化(hetero-activation)即由一种caspase活化另一种caspase是凋亡蛋白酶的酶原被活化的经典途径。被异源活化的Caspase又称为执行caspase(executioner caspase),包括Caspase-3,-6,-7。执行Caspase不象启动Caspase ,不能被募集到或结合起始活化复合体,它们必须依赖启动Caspase才能活化。
凋亡细胞的特征性表现,包括DNA裂解为200bp左右的片段,染色质浓缩,细胞膜活化,细胞皱缩,最后形成由细胞膜包裹的凋亡小体,然后,这些凋亡小体被其他细胞所吞噬,这一过程大约经历30-60分钟,Caspase引起上述细胞凋亡相关变化的全过程尚不完全清楚,但至少包括以下三种机制:
凋亡抑制物
正常活细胞因为核酸酶处于无活性状态,而不出现DNA断裂,这是由于核酸酶和抑制物结合在一起,如果抑制物被破坏,核酸酶即可激活,引起DNA片段化(fragmentation)。现知caspase可以裂解这种抑制物而激活核酸酶,因而把这种酶称为Caspase激活的脱氧核糖核酸酶(caspase-activated deoxyribonuclease CAD),而把它的抑制物称为ICAD。因而,在正常情况下,CAD不显示活性是因为CAD-ICAD,以一种无活性的复合物形式存在。ICAD一旦被Caspase水解,即赋予CAD以核酸酶活性,DNA片段化即产生,有意义的是CAD只在ICAD存在时才能合成并显示活性,提示CAD-ICAD以一种共转录方式存在,因而ICAD对CAD的活化与抑制却是必需要的。破坏细胞结构
Caspase可直接破坏细胞结构,如裂解核纤层,核纤层(Lamina)是由核纤层蛋白通过聚合作用而连成头尾相接的多聚体,由此形成核膜的骨架结构,使染色质(chromatin)得以形成并进行正常的排列。在细胞发生凋亡时,核纤层蛋白作为底物被Caspase在一个近中部的固定部位所裂解,从而使核纤层蛋白崩解,导致细胞染色质的固缩。
调节蛋白功能
Caspase可作用于几种与细胞骨架调节有关的酶或蛋白,改变细胞结构。其中包括凝胶原蛋白(gelsin)、聚合粘附激酶(focal adhesion kinase,FAK)、P21活化激酶α(PAKα)等。这些蛋白的裂解导致其活性下降。如Caspase可裂解凝胶原蛋白而产生片段,使之不能通过肌动蛋白(actin)纤维来调节细胞骨架。
除此之外,Caspase还能灭活或下调与DNA修复有关的酶、mRNA剪切蛋白和DNA交联蛋白。由于DNA的作用,这些蛋白功能被抑制,使细胞的增殖与复制受阻并发生凋亡。
所有这些都表明Caspase以一种有条不紊的方式进行"破坏",它们切断细胞与周围的联系,拆散细胞骨架,阻断细胞DNA复制和修复,干扰mRNA剪切,损伤DNA与核结构,诱导细胞表达可被其他的细胞吞噬的信号,并进一步使之降解为凋亡小体。
细胞凋亡受到严格调控,在正常细胞Caspase处于非活化的酶原状态,凋亡程序一旦开始,Caspase被活经随后发生凋亡蛋白酶的层叠级联反应,发生不可逆的凋亡——细胞调节细胞凋亡的举例如下。
凋亡抑制分子
迄今为止,人类已发现多种凋亡抑制分子,包括P35,CrmA,IAPs,FLIPs以及Bcl-2家族的凋亡抑制分子。
1)P35和CrmA是广谱凋亡抑制剂,体外研究结果表明P35以竞争性结合方式与靶分子形成稳定的具有空间位阻效应的复合体并且抑制Caspases活性,同时P35在位点DMQD!G被靶Caspases特异切割,切割后的P35与caspase的结合更强,CrmA(Cytokine response modfer A)是血清蛋白酶抑制剂,能够直接抑制多种蛋白酶的活性,但还未发现在哺乳动物中发现P35和CrmA的同源分子。
2)FLIPs(FLICE-imhibirory proterins)能抑制Fas/TNFR1介导的细胞凋亡。它有多种变异体,但其N-端功能前区(Prodomain)完全相同,C端长短不一。FLIPs通过DED功能区,与FADD和Caspase-8,10结合,拮抗它们之间的相互作用,从而抑制Caspase8,10募集到死亡受体复合体和它们的起始化。
3)凋亡抑制蛋白(IAPs,inhibitors of Apoptosisprotien)为一组具有抑制凋亡作用的蛋白质,首先是从杆状病毒基因组克隆到,发现能够抑制由病毒感染引起的宿主细胞死亡应答。其特性是有大约20氨基酸组成的功能区,这对IAPs抑制凋亡是必需要的,它们主要抑制Caspase3,-7,而不结合它的酶原,对Caspase则即可以结合活化的,又可结合酶原,进而抑制细胞凋亡。
Bcl-2家族
这一家族有众多成员,如Mcl-1、NR-B、A1 、Bcl-w、Bcl-x、Bax、Bak、Bad、Bim等,它们分别既有抗凋亡作用,也有促凋亡的作用。多数成员间有两个结构同源区域,在介导成员之间的二聚体化过程中起重要作用。Bcl-2成员之间的二聚体化是成员之间功能实现或功能调节的重要形式。Bcl-2生理功能是阻遏细胞凋亡,延长细胞寿命,在一些白血病中Bcl-2呈过度表达。
Bcl-2的亚细胞定位已经明确,它在不同的细胞类型可以定位于线粒体、内质网以及核膜上,并通过阻止线粒体细胞色素C的释放而发挥抗凋亡作用。此外, Bcl-2具有保护细胞的功能, Bcl-2的过度表达可引起细胞核谷胱苷肽(GSH)的积聚,导致核内氧化还原平衡的改变,从而降低了Caspase的活性。Bax是Bcl-2家族中参与细胞凋亡的一个成员,当诱导凋亡时,它从胞液迁移到线粒体和核膜。有人研究发现,细胞毒性药物诱发凋亡时,核膜Bax水平的上升与lamin及PARP两种核蛋白的降解呈正相关。用Bax寡核苷酸处理的细胞,只能特异地阻断Lamin的降解,对PARP的降解不起作用。这种效应的调控机制仍然不清楚。
总之,细胞凋亡的调节是非常复杂的,参与的分子也非常多,还有很多不为我们所知的机理需要我们一步的探索。
免疫学
1)胸腺细胞成熟过程中的凋亡:胸腺细胞经过一系列的发育过程而成为各种类型的免疫活性细胞。在这一发展过程中,涉及了一系列的阳性细胞选择和阴性细胞选择过程。以形成CD4+的T淋巴细胞亚型及CD8+的T淋巴细胞亚型;同时,对识别自身抗原的T细胞克隆进行选择性地消除,其细胞克隆死亡的机制主要是通过程序性细胞死亡。因此,正常的免疫系统发育的结局,既形成了有免疫活性的淋巴细胞,又产生了对自身抗原的免疫耐受。耐受机制的形成,主要靠识别自身抗原的T淋巴细胞克隆的程序性细胞死亡机制的活化。
2)活化诱导的细胞死亡:(activation-induced CELL death,AICD)是T淋巴细胞程序性死亡的又一个主要类型。正常的T淋巴细胞在受到入侵的抗原刺激后,T淋巴细胞被激活,并诱导出一系列的免疫应答反应。机体为了防止过高的免疫应答,或防止这种免疫应答无限制地发展下去,便有AICD来控制激活T细胞的寿命。实际上:T淋巴细胞的增殖与T淋巴细胞AICD具有共同的信号通路。T淋巴细胞受到刺激后就开始活化,活化以后的T淋巴细胞如果有生长因子的存在,即发生生殖反应,如果没有或较少的生长因子的存在,则发生AICD。3)淋巴细胞对靶细胞的攻击:免疫活性细胞,特别是淋巴因子激活的杀伤细胞(LAK),是过继性免疫治疗的一种重要形式。在抗肿瘤、抗病毒及免疫调节中具有重要作用。这些免疫活性细胞在攻击肿瘤细胞、病毒感染的细胞时,可诱导靶细胞发生程序性死亡。临床医学
细胞凋亡之所以成为人们研究的一个热点,在很大程度上决定于细胞凋亡与临床病毒的密切关系。这种关系不仅表现在凋亡及其机制的研究,阐明了一大类免疫病的发病机制,而且由此可以导致疾病新疗法的出现,特别是细胞凋亡与肿瘤及艾滋病之间的密切关系倍受人们重视。
1) HIV病毒感染造成CD4+细胞减少是通过细胞凋亡机制
HIV感染引起艾滋病,其主要的发病机制是HIV感染后特异性地破坏CD4+细胞,使CD4+以及与其相关的免疫功能缺陷,易招致机会性感染及肿瘤,但HIV感染后怎样特异性破坏CD4+细胞呢?一般认为,CD4+T淋巴细胞绝对数显著减少的原因,主要是通过细胞凋亡机制造成的。这不仅阐明了AIDS时CD4+T细胞减少的主要原因,同时也为AIDS的治疗研究指明了一个重要的探索方向。
2)从细胞凋亡角度看,肿瘤的发生是由于凋亡受阻所致
一般认为恶性转化的肿瘤细胞是因为失控生长,过度增殖,从细胞凋亡的角度看则认为是肿瘤的凋亡机制受到抑制不能正常进行细胞死亡清除的结果。肿瘤细胞中有一系列的癌基因和原癌基因被激活,并呈过表达状态。这些基因的激活和肿瘤的发生发展之间有着极为密切的关系。癌基因中一大类属于生长因子家族,也有一大类属于生长因子受体家族,这些基因的激活与表达,直接刺激了肿瘤细胞的生长,这些癌基因及其表达产物也是细胞凋亡的重要调节因子许多种类的癌基因表达以后,即阻断了肿瘤细胞的凋亡过程,使肿瘤细胞数目增加,因此,从细胞凋亡角度来理解肿瘤的发生机制,是由于肿瘤细胞的凋亡机制,肿瘤细胞减少受阻所致。因此,通过细胞凋亡角度和机制来设计对肿瘤的治疗方法就是重建肿瘤细胞的凋亡信号转递系统,即抑制肿瘤细胞的生存基因的表达,激活死亡基因的表达。
3)细胞凋亡的研究将给自身免疫病带来真正的突破
自身免疫病包括一大类难治性的免疫紊乱而造成的疾病,自身反应性T淋巴细胞及产生抗体的B淋巴细胞是引起自身免疫病的主要免疫病理机制,正常情况下,免疫细胞的活化是一个极为复杂的过程。在自身抗原的刺激作用下,识别自身抗原的免疫细胞被活化,从而通过细胞凋亡的机制而得到清除。但如这一机制发生障碍,那么识别自身抗原的免疫活性细胞的清除就会产生障碍。有人观察到在淋巴增生突变小鼠中观察到Fas编码的基因异常,不能翻译正常的Fas跨膜蛋白分子,如Fas异常,由其介导的凋亡机制也同时受阻,便造成淋巴细胞增殖性的自身免疫疾患。
4)神经系统的退行性病变:老年性痴呆是神经细胞凋亡的加速而产生的。阿尔茨海默病(AD)是一种不可逆的退行性神经疾病,淀粉样前体蛋白(APP)早老蛋白-1(PS1)早老蛋白-2(PS2)的突变导致家族性阿尔茨海默病(FAD)。研究证明PS参与了神经细胞凋亡的调控PS1、PS2的过表达能增强细胞对凋亡信号的敏感性。Bcl-2基因家族两个成员Bcl-xl和Bcl-2参与对细胞凋亡的调节。
线粒体是真核细胞的重要细胞器,是动物细胞生成ATP的主要地点。线粒体基质的三羧酸循环酶系通过底物脱氢氧化生成NADH。NADH通过线粒体内膜呼吸链氧化。与此同时,导致跨膜质子移位形成跨膜质子梯度和/或跨膜电位。线粒体内膜上的ATP合成酶利用跨膜质子梯度能量合成ATP。合成的ATP通过线粒体内膜ADP/ATP载体与细胞质中ADP交换进入细胞质,参与细胞的各种需能过程。
1951年,巴黎第八大学荣誉教授Glucksmann提出正常脊椎动物发育中的细胞死亡。1966年,saunders提出在形态发生中细胞死亡。1972年,Kerr提出细胞凋亡(apoptosis),说明这是在组织动力学方面有广泛作用的一种基本生物学现象。1974年,Lockshin提出细胞程序性死亡。美国麻省理工学院教授Horvitz在研究线虫发育时发现线虫的每个细胞的位置、分裂与命运都是由遗传决定的程序所精确地预先确定的。在构成成虫体时有1090个细胞诞生,131个细胞死亡。1993年,哈佛大学医学院细胞生物学系终身教授袁钧瑛发现线虫的死亡基因ced-3的产物在结构和功能上与哺乳类白细胞介素1β转换酶有同源性。此后,属于同一家族的十几个相关基因陆续在哺乳动物基因组中被发现。统称为胱冬肽酶(caspases)。1994年,瑞士苏黎世大学分子生命科学研究所Hengartner发现线虫的存活基因ced-9的产物与哺乳动物原癌基因bcl-2的产物相似。
细胞凋亡的特征是细胞由于降解酶,主要是水解酶(蛋白酶与核酸酶)的作用,在近乎正常的细胞质膜内趋向死亡。这与坏死时细胞质膜早期破损不同。在细胞凋亡过程中,质膜脂双层丧失二侧不对称性,磷脂酰丝氨酸暴露于细胞表面,从而导致被吞噬。
线粒体跨膜电位的耗散与细胞凋亡的密切关系
有陆续报道说明线粒体跨膜电位的耗散早于核酸酶的激活,也早于磷酯酰丝氨酸暴露于细胞表面。而一旦线粒体跨膜电位耗散,细胞就会进入不可逆的凋亡过程。线粒体解联的呼吸链会产生大量活性氧,氧化线粒体内膜上的心磷脂。实验证明,用解偶联剂mClCCP会导致淋巴细胞凋亡。而如果能稳定线粒体跨膜电位就能防止细胞凋亡。
通透性转变
在细胞凋亡过程中线粒体跨膜电位的耗散主要是由于线粒体内膜的通透性转变,这是由于生成了动态的由多个蛋白质组成的位于线粒体内膜与外膜接触位点的通透性转变孔道(PT孔道)(图1)。PT孔道由线粒体各部分的蛋白质与细胞质中蛋白质联合构成。这包括细胞液蛋白:己糖激酶,线粒体外膜蛋白:外周苯并二嗪(benzodiazepine)受体与电压依赖阴离子通道,线粒体膜间间隙蛋白:肌酸激酶,线粒体内膜蛋白:ADP-ATP载体,线粒体基质蛋白:亲环蛋白D(cyclophilin D)等。凡是能够专一作用于线粒体诱导PT孔道生成的物质,例如苯并二嗪受体的配基原卟啉IX等都能引起细胞凋亡。
PT孔道的性质
通过一些实验室的研究,以下诸点值得指出:⑴线粒体内膜通透性转变既是细胞凋亡的必须条件,也是它的充足条件。⑵PT孔道打开后导致线粒体许多功能的致命性变化从而启动了死亡途径。⑶PT孔道作为许多生理效应的感受器(二价阳离子、ATP、ADP、NAD、ΔΨm、pH、巯基与多肽),整合了电生理、氧化还原与细胞代谢状态的信息。⑷PT孔道的组成成分ADP-ATP载体是能量代谢的重要分子,由于ADP-ATP载体是由一个基因家族的几个成员所编码,它的表达有严格的组织专一性。因此,PT孔道在不同细胞中的调节可能稍有不同。⑸PT孔道的作用有自放大的效应。PT诱导ΔΨm耗散,而反过来 mClCCP使ΔΨm去极化会导致PT。一些PT的结果例如ΔΨm 耗散,活性氧的生成本身也会导致PT。这就说明PT会有正反馈, 从而在细胞凋亡中有自摧毁的作用。反过来,如果能防止ΔΨm的耗散,就能避免氧化还原不平衡、磷酯酰丝氨酸的暴露与蛋白酶和核酸酶的激活。
PT孔道开关
PT孔道有开放与关闭二种构象。PT孔道开放导致细胞凋亡。而PT孔道关闭能防止细胞凋亡。当PT孔道与环孢菌素A(cyclosporin A)或SH,或米酵菌酸(bongkrek acid)结合时PT孔道被关闭。在PT孔道开放时线粒体释放细胞凋亡诱导因子(AIF)。AIF可能是一种蛋白水解酶,位于线粒体膜间间隙,它能被蛋白酶抑制剂如N-苄氧羰基-缬氨酰-丙氨酰-门冬氨酰氟甲基酮(N-benzyloxycARBonyl-Val-Ala-Asp-fluoromethylketone)所抑制。此外从线粒体释放的细胞色素C也是一种细胞凋亡诱导因子。虽然苍术苷与米酵菌酸都是ADP-ATP载体的抑制剂,但是它们对PT孔道的作用并不相同。苍术苷促进PT通道开放。这可能与二种抑制剂和ADP-ATP载体的结合部位不同有关。苍术苷只能与ADP-ATP载体的胞液侧结合而米酵菌酸可与ADP-ATP载体的胞液及基质二侧结合。
线粒体作用
⑴若将纯化的正常的线粒体与纯化的细胞核在一起保温,并不导致细胞核的变化。但若将诱导生成PT孔道的线粒体与纯化的细胞核一同保温,细胞核即开始凋亡变化。⑵细胞死亡调节蛋白不论是抑制死亡的bcl-2家族还是促进细胞死亡的Bax家族均以线粒体作为靶细胞器。bcl-2蛋白的C端的疏水肽段能插入线粒体外膜。事实上相当量的bcl-2位于线粒体内外膜的接触位点。⑶高表达bcl-2能防止ΔΨm的耗散,从而导致对苍术苷、原卟啉IX与mClCCP的不敏感与AIF释放的抑制;反之,高表达Bax则导致ΔΨm的耗散。
综上所述,细胞凋亡与线粒体的结构与功能有着密切的关系。如果线粒体有大量PT孔道形成,细胞ATP浓度很快下降,则在致凋亡的蛋白酶被活化前细胞就坏死了。而如果PT孔道的诱导生成是一种比较缓和与持续的状态,在细胞ATP浓度下降前专一的蛋白酶被激活;而另一方面ΔΨm的耗散产生的超氧阴离子则导致细胞死亡。细胞凋亡是一把双刃剑。一方面是机体发育的正常过程,另一方面如果细胞凋亡过速,则会导致慢性退行性病变;如果细胞不凋亡就有可能导致癌变或对化疗的不敏感。进一步研究线粒体在细胞凋亡中的作用,有助于深入了解细胞凋亡的机制与对疾病的防治。
早期检测
1) PS(磷脂酰丝氨酸)在细胞外膜上的检测:PS从细胞膜内侧转移到外侧在细胞受到凋亡诱导后不久发生,可能作为免疫系统的识别标志。AnnexinV,一个钙依赖性的磷脂结合蛋白,能专一性的结合暴露在膜外侧的PS,再通过简单的显色或发光系统进行检测。由于这是一种凋亡早期的活细胞检测(悬浮细胞和贴壁细胞都适用),可与DNA染料或别的晚期检测方法相结合来标记凋亡的发展阶段。美国著名生物试剂公司CLONTECH和Invitrogen公司分别开发了多种标记的Annexin V产品,简便快速,10分钟就可完成检测。其中带荧光标记的Annexin V-EGFP(Enhanced Green Fluorescent protein)及Annexin V-FITC,灵敏度高,可作为FACS(流式细胞分选)方法筛选凋亡细胞的基础。由于融合蛋白Annexin V-EGFP,EGFP与PS 的结合比例为1:1,还可进行定量检测。除此之外,还提供生物素偶联的Annexin V,可通过常用的酶联显色反应来检测。另外,MACS公司将磁珠包被Annexin V,可采用磁分选方法筛选凋亡细胞。
2)细胞内氧化还原状态改变的检测:
这反应了细胞凋亡研究中相对较新的趋势,研究什么样的氧化还原环境引起下游事件的发生。CLONTECH公司的ApoAlERTTM GlutathioneDetECTion Kit通过荧光染料moNOchlorobimane(MCB)体外检测凋亡细胞细胞质中谷光苷肽的减少来检测凋亡早期细胞内氧化还原状态的变化。正常状态下,谷光苷肽(glutathione:GSH)作为细胞的一种重要的氧化还原缓冲剂。细胞内有毒的氧化物通过被GSH还原而定期去除,氧化型的GSH又可被GSH还原酶迅速还原。这一反应在线粒体中尤为重要,许多呼吸作用中副产物的氧化损伤将由此被去除。在Jurcat和一些其它类型的细胞中,细胞膜中有可被凋亡信号启动的ATP依赖的GSH转移系统。当细胞内GSH的排除非常活跃时,细胞液就由还原环境转为氧化环境,这可能导致了凋亡早期细胞线粒体膜电位的降低,从而使细胞色素C(三羧酸循环中的重要组分)从线粒体内转移到细胞液中,启动凋亡效应器caspase的级联反应。
由于 GSH与氧化还原作用及线粒体功能密切相关,此项检测除了对研究细胞凋亡的起始非常有用外,还可用于心脏病、中风等疾病治疗的研究。但有些细胞如:HeLa 和3T3细胞凋亡时没有明显的GSH水平的变化,不能用此法检测。
3)细胞色素C的定位检测
细胞色素C作为一种信号物质,在细胞凋亡中发挥着重要的作用。正常情况下,它存在于线粒体内膜和外膜之间的腔中,凋亡信号刺激使其从线粒体释放至细胞液,结合Apaf-1 (apoptoticprotease activating factor-1)后启动caspase级联反应:细胞色素C/Apaf-1复合物激活caspase-9,后者再激活caspase-3和其它下游caspase。细胞色素C氧化酶亚单位Ⅳ(cytochrome c oxidase subunit Ⅳ:COX4)是定位在线粒体内膜上的膜蛋白,凋亡发生时,它保留在线粒体内,因而它是线粒体富集部分的一个非常有用的标志。
ApoAlertTMCell Fractionation Kit不用超离心,可从凋亡和非凋亡细胞中快速有效分离出高度富集的线粒体部分,再进一步通过Western杂交用细胞色素C抗体和COX4抗体标示细胞色素C和COX4的存在位置,从而判断凋亡的发生。
4) 线粒体膜电位变化的检测:
在凋亡研究的早期,从形态学观测上线粒体没有明显的变化。随着凋亡机制研究的深入,发现线粒体凋亡也是细胞凋亡的重要组成部分,发生很多生理生化变化。例如,在受到凋亡诱导后线粒体转膜电位会发生变化,导致膜穿透性的改变。MitoSensorTM,一个阳离子性的染色剂,对此改变非常敏感,呈现出不同的荧光染色。正常细胞中,它在线粒体中形成聚集体,发出强烈的红色荧光。凋亡细胞中,因线粒体穿膜电位的改变,它以单体形式存在于细胞液中,发出绿色荧光。用荧光显微镜或流式细胞仪可清楚地分辨这两种不同的荧光信号。CLONTECH公司的ApoAlert Mitochondrial Membrane Sensor Kit就采用这种原理来检测线粒体膜电位的变化。但是,这种方法不能区分细胞凋亡或其他原因导致的线粒体膜电位的变化。
晚期检测
细胞凋亡晚期中,核酸内切酶(某些Caspase的底物)在核小体之间剪切核DNA,产生大量长度在180-200 bp 的DNA片段。对于这一现象的检测通常有以下两种方法:
1) Tunel(Terminal deoxynucleotidyl transferase-mediated dUTP nick-end-labeling)
通过DNA末端转移酶将带标记的 dNTP (多为dUTP)间接(通过地高辛)或直接接到DNA片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。美国Intergen公司提供多种标记方法,直接荧光标记,地高辛介导荧光标记或过氧化物酶联显色,可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。其中,直接标记步骤少,操作简便。而间接标记有信号放大的作用,检测灵敏度高。
2) LM-PCR Ladder (连接介导的PCR检测)
当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。CLONTECH公司的ApoAlert?LM-PCR Ladder Assay Kit通过LM-PCR(ligation-mediated PCR),连上特异性接头,专一性地扩增核小体的梯度片段,从而灵敏地检测凋亡时产生的核小体的梯度片段。此外,LM-PCR 检测是半定量的,因此相同凋亡程度的不同样品可进行比较。
上述两种方法都针对细胞凋亡晚期核DNA断裂这一特征,但细胞受到其它损伤(如机械损伤,紫外线等)也会产生这一现象,因此它对细胞凋亡的检测会受到其它原因的干扰。
3) Telemerase Detection (端粒酶检测)
这是相对来说推出较早,用得较多的一种方法。端粒酶是由RNA和蛋白组成的核蛋白,它可以自身RNA为模板逆转录合成端粒区重复序列,使细胞获得“永生化”。正常体细胞是没有端粒酶活性的,每分裂一次,染色体的端粒会缩短,这可能作为有丝分裂的一种时钟,表明细胞年龄、复制衰老或细胞凋亡的信号。研究发现,90%以上的癌细胞或凋亡细胞都具有端粒酶的活性。Invitrogen公司的TRAP-eze Telemerase Detection Kit在1996年率先推出。它提供特定的寡核苷酸底物,分别与底物及端粒重复序列配对的引物。如果待测样本中含有端粒酶活性,就能在底物上接上不同个数的6碱基(GGTTAG)端粒重复序列,通过PCR反应,产物电泳检测就可观察到相差六个碱基的DNA Ladder现象(参见图4)。此外,Intergen公司还提供用酶联免疫法(ELISA)检测的试剂盒.
同样,这种检测方法也不专对细胞凋亡,检测结果也不纯反应细胞凋亡的发生。
mRNA检测
研究者们发现了很多在细胞凋亡时表达异常的基因,检测这些特异基因的表达水平也成为检测细胞凋亡的一种常用方法。据报道,Fas 蛋白结合受体后能诱导癌细胞中的细胞毒性T细胞(cytotoxic T cells)等靶细胞。Bcl-2 和bcl-X (长) 作为抗凋亡(bcl-2 和bcl-X)的调节物,它们的表达水平比例决定了细胞是凋亡还是存活。一般多采用Northern杂交和RT-PCR走胶对它们进行检测。随着荧光定量PCR技术的发展,用定量PCR技术来检测基因表达水平无疑比之前者更快更准确。Invitrogen公司的Amplifluor Apoptosis Gene Systems就根据这一新技术原理,通过检测fas,bax-alpha 和 bcl-X (长的) 基因的 mRNA表达水平来进行细胞凋亡的检测。
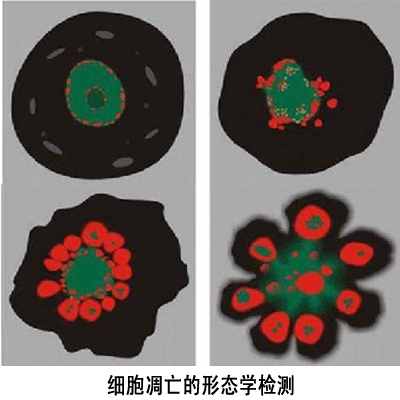
形态学检测
根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。1. 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。
贴壁细胞出现皱缩、变圆、脱落。
2. 染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割
成块状和凋亡小体等典型的凋亡形态。
2.荧光显微镜和共聚焦激光扫描显微镜
一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。
常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258),DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。
Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。
DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。
结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体。
结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构;Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。
细胞凋亡检测
细胞凋亡在胚胎发育、造血、免疫系统的成熟以及维护正常组织和器官的细胞恒定与生长平衡,乃至机体衰老方面都起着重要作用。因此,有关凋亡的研究在临床和基础等各个领域已经广泛开展,凋亡细胞的检测方法显得非常重要。流式细胞仪( Flow cytometry ,FCM) 将流体喷射技术、激光光学技术、电子技术和计算机技术等集于一体,较其它方法有不可比拟的优越性,既可定性又可定量,且具有简单、快速和敏感性高的特点,可进行多参数和活体细胞分析。在APO 的研究得到较为广泛的应用,开辟了新途径。
1 光散射法
在FCM 系统中,被检细胞在液流中通过仪器测量区时,经激光照射,细胞向空间360°立体角的所有方向散射光线,其中前向散射光( FSC) 的强度与细胞大小有关,而侧向散射光(SSC) 的强度与质膜和细胞内部的折射率有关。细胞凋亡时,细胞固缩,体积变小,核碎裂形成,细胞内颗粒往往增多,故凋亡细胞FSC 降低而SSC 增高。细胞坏死由于胞体肿胀,细胞核亦碎裂分解故FSC 和SCC 均增高。正常细胞FSC 高而SSC 低。根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞表面免疫荧光分析结合起来,用以区别辩认经这些特殊处理发生选择凋亡的淋巴细胞亚型,也可用于活细胞分类。值得注意的是,根据FSC 和SSC 判断凋亡细胞的可靠性受被测细胞形态上的均一性和核细胞浆比率影响很大,因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好而在肿瘤细胞凋亡中其可靠性较差。
2 细胞DNA 含量的测定
细胞凋亡时,核酸内切酶激活,导致DNA 断裂,这是凋亡的特征性表现,也为FCM 鉴别凋亡细胞奠定了基础。而检测细胞凋亡DNA 断裂的方法中,最常用、最简便的就是细胞DNA 含量分析。当细胞用乙醇、TrtionX—100 处理后细胞膜上出现漏洞,小片段DNA 从细胞内释放出来,使其DNA 含量低于正常细胞的二倍体。用碘化丙啶( PI) 染色后分析,可在二倍体C0/ G1 ,峰前出现“亚二倍体”峰,即细胞凋亡峰(APO峰) ,根据APO 峰可测出凋亡细胞百分率,该法简单易行,可大批定量检测凋亡标本,亦可同时分析细胞的细胞周期位置。另外,应用FCM 方法通过对DNA 和RNA 的联合检测可以鉴别出G0 期细胞,因此,可分析细胞凋亡与G1 或G0 细胸的关系。DNA 降解的程度取决于凋亡的阶段、细胞的类型和凋亡诱发因子的特性。染色过程中DNA 的逸出量变化也影响FCM 检测结果。据研究,将高浓度的磷酸盐———枸椽酸盐缓冲液加入漂洗液中,可增高降解DNA 的逸出量,从而提高鉴别凋亡细胞与正常细胞的能力。
DNA 含量测定在检测细胞凋亡中的局限性在于其特异性和敏感性均不高。特异性不高是因为APO 峰代表了一组细胞群体,包括凋亡细胞、机械损伤细胞、低DNA 含量的细胞或不同染色体结构的细胞,在上述情况下,DNA 与荧光染料的结合量均小。另外,非固定的细胞在低渗溶液中被溶解时,可导致大量的核碎片出现,此时APO 峰的细胞数目只代表了核碎片的数目,并不代表凋亡细胞数目。敏感性较差的原因是细胞凋亡早期只有DNA 断裂点出现,但尚未出现DNA 片段的大量丢失,所以该法不能检出早期凋亡细胞和发生于S 期或G2/ M 期的凋亡细胞,因为其实际含量不低于二倍体细胞所含的DNA ,因此该法进行凋亡细胞分析时应结合其它形态或生化方法,以期更准确地分析细胞的凋亡状态。
3 Y 啶橙染色法( Acridine OrAnge ,AO)
AO 可将细胞或细胞核中的双链DNA 和变性DNA 染成不同颜色的荧光。AO 插入双链DNA 中时,发绿色荧光;AO也可与单链或通过变性而产生的DNA 单链发生作用,这时发出红色荧光,因此,通过FCM 检测不同的荧光,可判断凋亡的发生。在测定被标准化后,绿色和红色荧光强度的量与总DNA 含量成比例,红色荧光与总体细胞(红色加绿色) 荧光的比率表示细胞中变性DNA 的比例,因此,这种方法可用于评价DNA 对原位变性的敏感性。有时候,凋亡细胞DNA 降解不明显,依赖于DNA 降解来检测细胞凋亡的方法如细胞DNA含量测定、DNA 末端标记等就难以检测到细胞凋亡变化。AO法检测凋亡的原理不依赖于DNA 片断的产生,因此其最主要的优点是可应用于寡核小体片段与凋亡不相平衡等情况,但AO 染色法不能有效区分有丝分裂细胞和凋亡细胞。
4 若丹明( Rh123) 染色法
细胞生活状态下,胞膜上的钠- 钾泵、钙泵等的作用,使细胞膜内外维持着不同离子的浓度梯度,包括Na + , K+ ,Cl - ,Ca2 + 等,形成细胞膜电位。FCM 可以检测亲脂性离子荧光染料在胞膜内外的分布,来测量膜电位的高低,以评价细胞的活力。Rh123 是一种亲脂性阳离子荧光染料,对细胞膜具有通透性,线粒体膜尤敏感。细胞存活状态时,若丹明123 通过细胞膜,积聚于线粒体发出绿色荧光。在细胞凋亡时,线粒体膜的转运能力下降,电负性降低,故细胞线粒体积聚Rh123 的能力也丧失,荧光强度降低,据此检测细胞的凋亡变化。但应指出,在凋亡的早期阶段,由于胞膜尚完整,大多数细胞器和细胞功能相对较好,因此,Rh123 法对于早期凋亡细胞和活细胞的鉴别比较困难。
5 原位末端标记技术
细胞凋亡时,DNA 断裂早于形态学改变及DNA 含量减少,原位末端标记( ISEL) 是将渗入到凋亡细胞中的外源性核苷酸在酶和DNA 的催化下与凋亡细胞因内源性核酸酶的激活而产生的单股或双股断裂相结合,较前述方面具更高灵敏性。通常有两种方法: ①DNA 聚合酶I 或klenow 大片段介导的单位缺口平移( INST) ; ②末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记( TUNEL) 。
INST 是利用DNA 多聚酶将核苷酸整合到凋亡细胞内断裂的DNA 处的3’末端,同时水解5’末端,以修复DNA ,若使用已标记的核苷酸即可显示出有断裂DNA 的细胞。1993 年,Gorczyca 等提出了末端脱氧核糖核酸转移酶( TdT) 标记法采检测凋亡细胞的DNA 断裂,此种方法已得到广泛应用。由于内源性核酸内切酶激活,细胞自身的染色质或DNA 被切割,并产生与DNA 断点数目相同的3’2 羟基末端, TdT 可以将生物素化的dUTP 标记至3’2 羟基末端,通过卵白素2FITC 系统,使DNA 的断点部位发生特异荧光而签别出凋亡细胞,TdT 末端标记法是鉴别凋亡细胞比较特异的一种方法。脑组织中的凋亡细胞很少,因此基因组DNA 片断需要更灵敏的检测技术。将TUNEL 法与FCM 结合起来可以提高检测凋亡细胞中DNA 片断的灵敏度。经凋亡诱导因子处理一定时间后的细胞,原位末端标记的凋亡比Hoechst33342 染色显示的要多,提示TUNEL 可检测出尚未出现明显凋亡形态学特征但已发生DNA 裂解的核,从而使检测的灵敏度提高。对比研究表明, TUNEL 的敏感性远远高于ISNT ,尤其在APO早期TUNEL 法阳性率较高,可能是APO 发生时DNA 多数为双链同时断裂,单链少见的原因。后者是依赖DNA 多聚酶介导的修复反应,故ISNT 的阳性率相对较低。TUNEL 还可结合细胞同期的分析,可同时了解凋亡细胞DNA 断裂和细胞周期分布之间的关系,近来已成为鉴别和定量凋亡细胞的最常用方法之一。但由于断裂DNA 的标记过程比较复杂,涉及多种因素,所以末端标记的阴性结果并不一定代表DNA链的完整,应排除方法上的问题,如TdT 酶活力的丧失等诸多影响因素。因此应用TdT 末端标记法鉴别凋亡细胞必须同时设阳性及阴性对照组,以便得到可靠结果。
6 Annexin V/ PI 法
1992 年Fadok 报道在APO 早期位于细胞膜内侧的磷脂酰丝氨酸(phosphatidylserin ,PS) 迁移至细胞外侧,这一现象出现在核染色质变性与核体积缩小之前。AnnexinV 是一种具有很强的抗凝血特性的血管蛋白,和磷脂有高亲合力,尤其与带负电荷的磷脂如PS 具极强的结合力,利用其特性可以检测细胞凋亡。但坏死细胞PS 亦暴露于外表使Annexin V 结合阳性,因此使用Annexin V 这一参数不能区分坏死或凋亡,必须同时采用PI 这一参数将坏死细胆区分开来。FCM 通过Annexin V —FITC 标志暴露于细胞膜上的PS 结合PI 进入损伤细胞膜标记降解DNA 分析凋亡与坏死细胞。在检测时有4个亚群包括机械性损伤细胞(Annexin - / P1 + ) 、正常细胞(An2nexin - / PI - ) 、凋亡细胞(Annexin + / PI - ) 和继发性坏死细胞(Annexin + / PI + ) 被区分。Boersma 等应用Ampexin V2FITE染色法检测细胞毒药物处理后的中国仓鼠细胞凋亡变化,FCM 检测发现荧光信号强弱不同的两种细胞亚群。进一步形态学等证实弱荧光细胞亚群代表早期凋亡细胞,强荧光亚群代表晚期凋亡细胞,可见其是检测和定量凋亡细胞的一种较为可靠的方法。细胞凋亡时膜上PS 外露早于DNA 断裂发生,因此该法检测早期凋亡更为灵敏,且该法不需要固定细胞,避免了PI 法因固定造成的细胞碎片过多及TUNEL 法因固定出现的DNA 片段丢失,因此更加省时,结果亦更可靠,是目前最为理想的凋亡定量检测方法。
7 其 他
7.1 ssDNA 单抗法 把抗单链DNA(ssDNA) 单克隆抗体用于细胞凋亡的检测,是一种偶然发现,因为在应用ssDNA 单抗(荧光法) 检测细胞毒性药物诱导DNA 损伤中,观察到凋亡的白血病细胞(MOL T24) 有较强的荧光,后来经过适当的改进,证明ssDNA 单抗可以特异地识别凋亡细胞。与TUNEL法相比,ssDNA 具有更强的灵敏性。TUNEL 法检测的凋亡细胞可能只是单抗法检测的凋亡细胞中的一个亚类。ssDNA法检测APO 一般用免疫荧光法。但也可和FCM 结合应用。单抗法使用简便、成本低、应用广泛。ssDNA 单抗可以区别坏死和凋亡、甚至能检测前期凋亡,凋亡后坏亡和一些特殊的凋亡形式(如无片段化的细胞凋亡) 。因此, ssDNA 单抗法可望成为一种新的特异灵敏检测细胞凋亡的方法。
7.2 细胞凋亡的相关蛋白分析 研究发现,有不少基因参加凋亡调控,这些基因产物可参与促进或抑制APO 的发生、发展,因此检测凋亡调节基因蛋白对研究APO 及其调控有重要作用。迄今为止,已可对大量细胞凋亡调节基因的蛋白产物分析,如P35蛋白、caspases、C2myc、Fas 抗原、TNF、bcl22 家族蛋白、cyclin、ras 等。FCM 用荧光标记的各种调控蛋白单抗染色,收集不同波长的荧光信号,检测细胞膜表面或细胞内荧光分子数量,可以了解每个细胞的变化,而且所需样品少,方法简便、快捷、准确。
8 展 望
近几年来,随着FCM 技术的不断发展和APO 研究的逐渐深入,FCM 在细胞凋亡研究中日益广泛。应用FCM 定量检测凋亡细胞简便、快速、客观,并可进行多参数检测,因此,可同时对APO 及其相关的癌基因表达、细胞周期分布等诸多因素进行相关分析,可以比较深入地了解凋亡的调节机制。尽管应用FCM 进行细胞凋亡研究的方法较多,但FCM检测凋亡细胞的方法一般基于细胞凋亡过程中形态、生化等某一方面的特性,因而难于了解凋亡过程中发生的各种变化的相互关系,也使该类方法缺乏特异性,所以,联合应用多种针对不同特性的FCM 检测方法,才能更为有效地鉴别凋亡细胞。同时,FCM 研究结果尚需同时结合形态学观察或生物化学方法,才能更加深入地了解凋亡细胞的生物学特性。随着生物技术的发展及人们对APO 本质认识的深入,相信在不久的将来,定会有更为特异和敏感的方法问世,有助于细胞凋亡取得突破性进展。