-
氢气 编辑
中文名:氢气
外文名:hydrogen
化学式:H2
分子量:2.01588
CAS登录号:1333-74-0
EINECS登录号:215-605-7
熔点:-259.2℃(101kPa)
沸点:-252.87℃(101kPa)
水溶性:难溶于水
密度:0.0899kg/m³(101.325kpa,0°C)
外观:
应用:工业燃料、金属冶炼、有机合成等
安全性描述:S9;S16;S33
危险性符号:F+
危险性描述:R12
UN危险货物编号:1950
在化学史上,人们把氢元素的发现与“发现和证明了水是氢和氧的化合物而非元素”这两项重大成就,主要归功于英国化学家和物理学家亨利·卡文迪许。
在18世纪末以前,曾经有不少人做过制取氢气的实验,所以实际上很难说是谁发现了氢,即使公认对氢的发现和研究有过很大贡献的卡文迪许本人也认为氢的发现不只是他的功劳。早在16世纪,瑞士著名医生帕拉塞斯就描述过铁屑与酸接触时有一种气体产生;17世纪时,比利时著名的医疗化学派学者扬·巴普蒂斯塔·范·海尔蒙特(Jan Baptista van Helmont,1580-1644)曾偶然接触过这种气体,但没有把它离析、收集起来;波义耳(RobERT Boyle,1627-1691)虽偶然收集过这种气体,但并未进行研究。他们只知道它可燃,此外就很少了解;1700年,法国药剂师勒梅里(Lemery, N. 1645-1715)在巴黎科学院的《报告》上也提到过它。
但是,最早把氢气收集起来,并对它的性质仔细加以研究的是卡文迪许。1766年卡文迪许向英国皇家学会提交了一篇研究报告《人造空气实验》,讲了他用铁、锌等与稀硫酸、稀盐酸作用制得“易燃空气”(即氢气),并用普利斯特里(J.Joseph Priestley,1733-1804)发明的排水集气法把它收集起来,进行研究。他发现一定量的某种金属分别与足量的各种酸作用,所产生的这种气体的量是固定的,与酸的种类、浓度都无关。他还发现氢气与空气混合后点燃会发生爆炸;又发现氢气与氧气化合生成水,从而认识到这种气体和其它已知的各种气体都不同。但是,由于他是燃素说的虔诚信徒,按照他的理解:这种气体燃烧起来这么猛烈,一定富含燃素; 硫磺燃烧后成为硫酸,那么硫酸中是没有燃素的;而按照燃素说金属也是含燃素的。所以他认为这种气体是从金属中分解出来的,而不是来自酸中。他设想金属在酸中溶解时,“它们所含的燃素便释放出来,形成了这种可燃空气”。他甚至曾一度设想氢气就是燃素,这种推测很快就得以当时的一些杰出化学家舍勒·基尔万(Kirwan, R. 1735-1812)等的赞同。由于把氢气充到气球中,气球便会徐徐上升,这种现象当时曾被一些燃素学说的信奉者们用来作为他们“论证”燃素具有负重量的根据。但卡文迪许究竟是一位非凡的科学家,后来他弄清楚了气球在空气中所受浮力问题,通过精确研究,证明氢气是有重量的,只是比空气轻很多。他是这样做实验的:先把金属和装有酸的烧瓶称重,然后将金属投入酸中,用排水集气法收集氢气并测体积,再称量反应后烧瓶及内装物的总量。这样他确定了氢气的比重只是空气的9%.但这些化学家仍不肯轻易放弃旧说,鉴于氢气燃烧后会产生水,于是他们改说氢气是燃素和水的化合物。
水的合成否定了水是元素的错误观念,在古希腊:恩培多克勒提出,宇宙间只存在火、气、水、土四种元素,它们组成万物。从那时起直到18世纪70年代,人们一直认为水是一种元素。1781年,普利斯特里将氢气和空气放在闭口玻璃瓶中,用电火花引爆,发现瓶的内壁有露珠出现。同年卡文迪许也用不同比例的氢气与空气的混合物反复进行这项实验,确认这种露滴是纯净的水,表明氢是水的一种成分。这时氧气也已发现,卡文迪许又用纯氧代替空气进行试验,不仅证明氢和氧化合成水,而且确认大约2份体积的氢与1份体积的氧恰好化合成水(发表于1784年)。这些实验结果本已毫无异议地证明了水是氢和氧的化合物,而不是一种元素,但卡文迪许却和普利斯特里一样,仍坚持认为水是一种元素,氧是失去燃素的水,氢则是含有过多燃素的水。他用下式表示“易燃空气”(氢)的燃烧:
(水+燃素)+(水-燃素)→水
1782年,拉瓦锡重复了他们的实验,并用红热的枪筒分解了水蒸气,明确提出正确的结论:水不是元素而是氢和氧的化合物,纠正了两千多年来把水当做元素的错误概念。1787年,他把过去称作“易燃空气”的这种气体命名为“Hydrogen”(氢),意思是“产生水的”,并确认它是一种元素。
氢气是无色并且密度比空气小的气体(在各种气体中,氢气的密度最小。标准状况下,1升氢气的质量是0.089克,相同体积比空气轻得多)。因为氢气难溶于水,所以可以用排水集气法收集氢气。另外,在一个标准大气压下,温度-252.87℃时,氢气可转变成无色的液体;-259.1℃时,变成雪状固体。
沸点 | -252.8 ℃(101 kPa) | 熔点 | -259.2 ℃(101 kPa) |
密度 | 0.089 g/L(101.325 kpa, 0°C) | 气液容积比 | 974 L/L(15℃,101 kPa) |
2.01588 | 临界密度 | 66.8 kg/m3 | |
三相点 | -254.4 ℃ | 临界压力 | 1.313 MPa |
熔化热 | 48.84 kJ/kg(-254.5℃,平衡态) | 3.72 mN/m(平衡态,-252.8℃) | |
热值 | 1.4×108 J/kg(2.82×105 J/mol) | 折射系数 | 1.0001265(1 atm,25℃) |
比热比 | Cp/Cv=1.40(1 atm,25℃,气体) | 易燃性级别 | 4 |
比热容 (cp) | 14.30 kJ/(kg·K), (1 atm,25℃) | 比热容 (cv) | 10.21 kJ/(kg·K), (1 atm,25℃) |
汽化热 | 305 kJ/kg(△H ,-249.5℃) | 临界温度 | -239.97℃ |
比容 | 11.12 m3/kg(1 atm,21.2℃) | 蒸汽压力 | 53.33 kPa(正常态,21.621 K) 119.99 kPa(正常态,24.249 K) |
粘度 | 0.010 mPa·S(1 atm,0 ℃) | 导热系数 | 0.1289 W/(m·K)(1 atm,0 ℃) |
金属态氢
金属氢,是液态或固态氢在上百万大气压的高压下变成的导电体。导电性类似于金属,故称金属氢。金属氢是一种高密度、高储能材料。
2017年1月26日,《科学》杂志报道哈佛大学实验室成功制造出金属氢。
综述
常温下,氢气的性质很稳定,不容易跟其它物质发生化学反应。但当条件改变时(如点燃、加热、使用催化剂等),情况就不同了。如氢气被钯或铂等金属吸附后具有较强的活性(特别是被钯吸附)。金属钯对氢气的吸附作用最强。氢气与电负性大的元素反应显示还原性,与活泼金属单质常显示氧化性。氢气在催化剂的存在下能与大部分有机物进行加成反应。
还原性
可燃性
氢气是一种极易燃的气体,燃点只有574℃,在空气中的体积分数为4%至75%时都能燃烧。氢气燃烧的焓变为−286kJ/mol:
2 H2(g) + O2(g) → 2 H2O(l),ΔH = -572 kJ/mol
当空气中氢气浓度在4.1%至74.8%时,遇明火即可引起爆炸。氢气的着火点为500°C。纯净的氢气与氧气的混合物燃烧时放出紫外线。
在带尖嘴的导管口点燃纯净的氢气,纯净的氢气在空气里安静地燃烧,产生淡蓝色的火焰(氢气在玻璃导管口燃烧时,火焰常略带黄色)。用烧杯罩在火焰的上方时,烧杯壁上有水珠生成,接触烧杯的手能感到发烫。
氢气在空气里燃烧,实际上是氢气跟空气里的氧气发生了化合反应,生成了水并放出大量的热。
反过来,氢气可以用电解水的方式制备。这个反应的化学方程式是:
催化下与氧气反应
氢气在氧气过量和低温有催化剂的条件下可直接生成过氧化氢,副产物为水。(过氧化物中氧元素的化合价为-1)
与卤素反应
氢气可将卤素还原为负价的离子。如,氢气在光照条件下可和氯气反应,生成氯化氢气体:
氢气与氟气混合,即使在阴暗的条件下,也会立刻爆炸,生成氟化氢气体:
与金属氧化物反应
氢气具有还原性,能将金属氧化物还原为金属单质。如,氢气能迅速地还原氯化钯的水溶液:
在加热条件下氢气能与将氧化铜还原为橙色的金属铜并产生水。
与二氧化碳反应
二氧化碳氢气在高温高压下常生成甲烷和水:
与氮气反应
氮气与在催化剂存在下与氢气高温高压生成氨气,工业常常采用这种方法制备氨气。
与烯烃反应
在反应过程中要打开烯烃的一个π键及一个H-H键,生成两个C-H键。反应是放热的,但即使是一个放热反应,在无催化剂时,反应也很难进行,这说明反应的活化能很高。在催化作用下烯烃与氢可顺利加成。如丙烯与氢气在催化剂的存在下生成丙烷:
显然,催化剂的作用是降低了反应的活化能,简单地说,催化剂将氢与烯烃都吸附在其表面,从而促进反应的进行。
与炔烃反应
一般炔烃在用铂、钯等催化氢化时,通常得到烷烃。如乙炔在铂的存在下与氢气反应乙烷:
与苯反应
苯在镍的存在下与氢气加热,能与氢发生加成反应,生成环己烷。
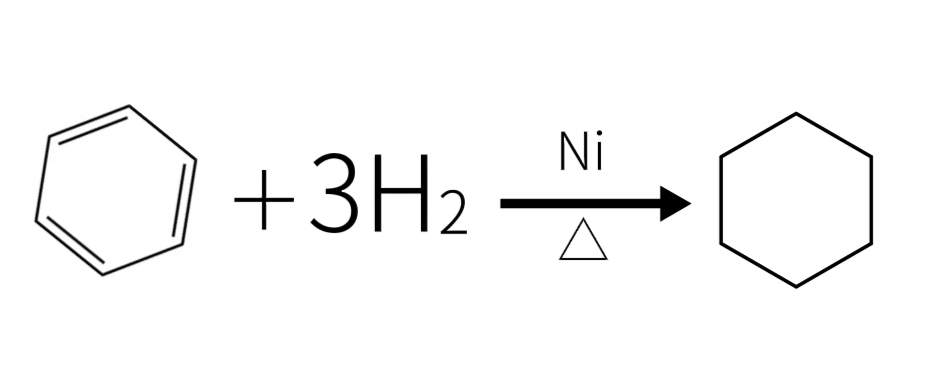 苯与氢气反应
苯与氢气反应
还原羰基化合物
羰基化合物能被氢气还原。如,醛或酮经催化氢化可分别还原为伯醇或仲醇。
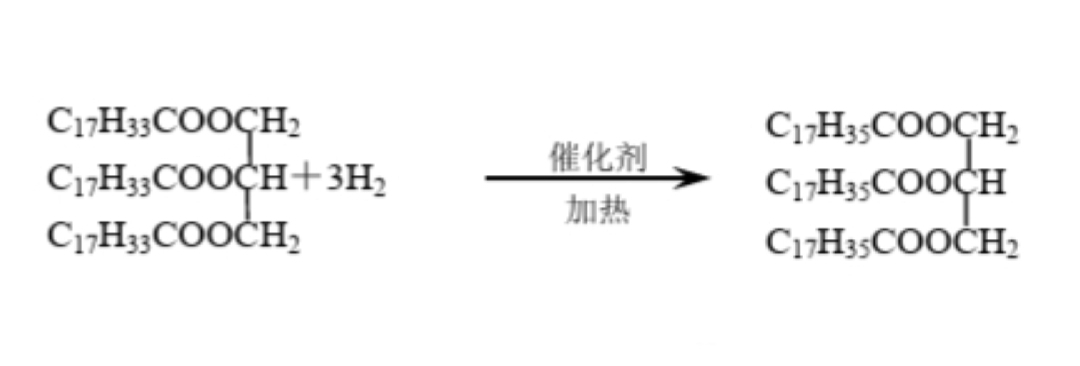
油脂的氢化
含不饱和脂肪酸的油脂,在催化剂作用下可以加氢,加氢的结果是液态的油转化为半固态的脂肪,因此油脂的氢化也叫“油脂的硬化”。
Rosenmund还原反应
Rosenmund还原反应就是酰氯在部分失活的钯催化剂(Pd/BaSO4)作用下与氢气进行还原得到醛。如,乙酰氯与氢气在催化下生成乙醛与氯化氢。
与硫缩酮反应
氢气在雷尼镍的催化下能将硫缩酮脱硫生成烃类。
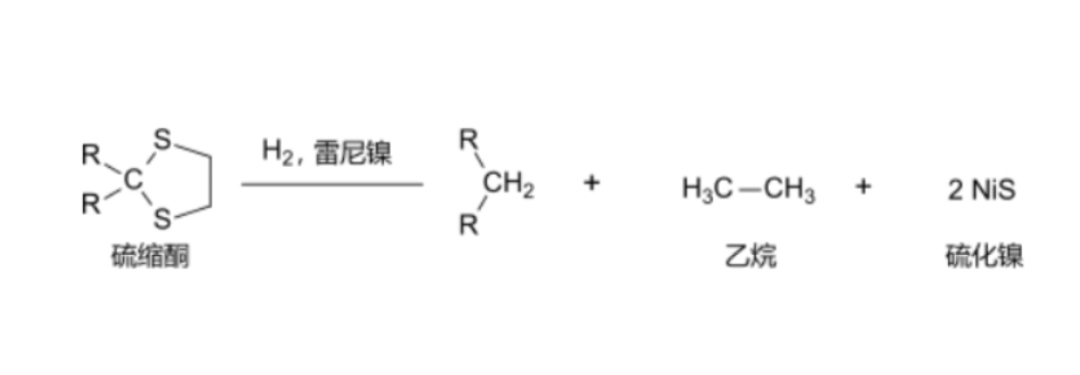 氢气在雷尼镍存在下与硫缩酮反应
氢气在雷尼镍存在下与硫缩酮反应
还原酰胺
氢气在催化剂存在下能将酰胺还原成胺,如乙酰胺在催化下与氢气反应生成乙胺:
还原硝基
硝基可以被氢气还原为氨基,如硝基苯在钯碳催化剂下能被氢气还原为氨基苯:
氧化性
与活泼金属反应
氢气对活泼的金属常显示氧化性,因为氢气是由氢原子共价形成的双原子分子,而每个氢原子可以分别获得一个电子形成负氢离子。如氢气与金属锂在加热条件下生成氢化锂:
工业用途
1、氢气是一种良好的化工原料,耗用氢气量最大的是合成氨,世界上约百分之六十的氢气用于合成氨,中国的比例更高。其次是经合成气(H2/CO2)制甲醇。氢与氯可合成氯化氢而制得盐酸。 除能制氨和合成盐酸外,氢气还能还原有机物的硝基为氨基,如硝基苯氢化还原可制苯胺。用酮或醛和氢气还原烷化能制各种有机产品,例N-烷基-N苯基对苯二胺、防老剂4010,防老剂4020等。
2、由于氢气具有良好的还原性,且无污染,因此氢可代替碳作还原剂用于金属冶炼;此外,氢气还可用于光导纤维生产,金属的切割焊接,氢燃料电池汽车,分布式发电等。
3、在一般情况下,氢极易与氧结合。这种特性使其成为天然的还原剂使用于防止出现氧化的生产中。在玻璃制造的高温加工过程及电子微芯片的制造中,在氮气保护气中加入氢以去除残余的氧。在石化工业中,需加氢通过去硫和氢化裂解来提炼原油。氢的另一个重要的用途是对人造黄油、食用油、洗发精、润滑剂、家庭清洁剂及其它产品中的脂肪氢化。
4、氢气还可用作工业燃料,氢气作燃料用的优点之一就是分子量最低,而氢和氧的燃烧热值高,可达28670千卡/千克,比液氧和煤油的热值(10000千卡/千克左右)高得多,液氢是优良的火箭发动燃料,也可用于航天飞机的推进剂。据报导,中国从六十年代以来,已能生产液氢用于国防工业,先后建造了150、200、1500L/h的液氢生产设备,日总生产能力达数吨。除此以外,还拥有容积为60m³、70m³的液氢槽车和多种规格的液氢公路槽车,以及贮运中的相关技术装备。中国1984年4月8日发射的第一颗试验通信卫星,使用的就是液氢和液氧推进剂。
氢能源在工业中的优缺点
氢气无毒,不像有些燃料,如甲醇、一氧化碳毒性很大。并且氢气在开放的大气中,很容易快速逃逸,而不像汽油蒸汽挥发后滞留在空气中不易疏散(这使得事故发生时它的影响范围要小得多)。氢气燃烧不冒烟,只生成水,不会污染环境。
但氢能源的利用也有其不利因素。氢是易燃气体、着火点能量很小,在空气中氢的最小着火能量仅为0.019mJ,在氧气中的最小着火能量更小,仅为0.007mJ。氢的另一个危险性是它和空气混合后的燃烧浓度极限的范围很宽,按体积比计算其范围为4%一75%,因此不能因为氢的扩散能力很大而对氢的爆炸危险放松警惕。
医疗用途
已有研究发现,氢气对于抗氧化、抗衰老、增强免疫力、对于人体自身修复、改善过敏体质、促进新陈代谢都有良好的功效。
但是,将氢分子融入饮用水中,其有效性和安全性并没有数据支持。而且人体本身就可以由肠内细菌产生氢分子,其产生量随食物纤维等的摄取量而变高。
因此,饮用富氢水是否能真正起作用还没有定论。
环境危害
氢气极易燃,和氟气、氯气、氧气、一氧化碳以及空气混合均有爆炸的危险,其中,氢气与氟气的混合物在低温和黑暗环境就能发生自发性爆炸,与氯气的混合体积比为1:1时,在光照下也可爆炸。氢气由于无色无味,燃烧时火焰是透明的,因此其存在不易被感官发现,在许多情况下向氢气中加入有臭味的乙硫醇,以便使嗅觉察觉,并可同时赋予火焰以颜色。气体比空气轻,在室内使用和储存时,漏气上升滞留屋顶不易排出,遇火源即会引起爆炸。
健康危害
接触类型 | 危害 | 预防 | 急救 |
吸入 | 保持室内通风 | ||
皮肤接触 | 接触液化氢气会导致皮肤冻伤 | 戴手套,穿防护服 | 冻伤时用大量水冲洗,不要脱去衣服,立即给予医疗护理 |
眼睛接触 | 接触液化氢气会导致眼睛冻伤,视线模糊 | 戴防护眼罩或佩戴面具 | 冻伤时,用大量水冲洗。立即给予医疗护理。 |
危害防治
密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员穿防静电工作服。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。防止气体泄漏到工作场所空气中。避免与氧化剂、卤素接触。在传送过程中,钢瓶和容器必须接地和跨接,防止产生静电。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。
应急处理:迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防静电工作服。尽可能切断泄漏源。合理通风,加速扩散。如有可能,将漏出气用排风机送至空旷地方或装设适当喷头烧掉。漏气容器要妥善处理,修复、检验后再用。
灭火方法:切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂:雾状水、泡沫、二氧化碳、干粉。
储存方法
气氢储存
氢气因为是易燃压缩气体,故应储存于阴凉、通风的仓间内。仓内温度不宜超过30℃。远离火种、热源。防止阳光直射。应与氧气、压缩空气、卤素(氟气、氯气、溴)、氧化剂等分开存放。储存间内的照明、通风等设施应采用防爆型,开关设在仓外,配备相应品种和数量的消防器材。禁止使用易产生火花的机械设备工具。验收时要注意品名,注意验瓶日期,先进仓的先发用。搬运时轻装轻卸,防止钢瓶及附件破损。
气态高压储氢是最普通和最直接的储存方式。目前中国使用水容积为40升的钢瓶在15MPa高压储存氢气。这样的钢瓶只能储存6m³标准氢气,还不到高压钢瓶重量的1%。很明显它的缺点是储氢量小,运输成本过高。
液氢储存
通过氢气绝热膨胀而生成的液氢也可以作为氢的储存方式。液氢沸点仅20.38K,气化潜热小,仅0.91kJ·mol/L,因此液氢的温度与外界的温度存在巨大的温差,稍有热量从外界渗人容器,即可快速沸腾而导致损失。液氢的理论体积密度也只有70kg/m³,考虑到容器和附件的体积,液氢系统的储氢密度还不到40kg/m³。
液氢方式储运的优点是质量储氢密度高,但同样存在成本问题和液氢蒸发损失的问题 。
运输方法
气氢输送
氢气的密度特别小,为了提高输送能力,一般将氢气加压,使体积大大缩小,然后装在高压容器中、用船舶或牵引忙车进行较长距离的输送。在技术上,这种运输方法已经相当成熟。
液氢输送
当液氢生产厂离用户距离较远对,可以把液氢装在专用低温绝热槽罐内。放在机车、卡车、船舶或者飞机上运输,这是一种既能满足较大输氢量,又是比较经济、快速的运氢疗式。
固氢运输
用金属储氢材料储存与输送氧比较简单,即用储氢合金储存氢气,然后运输装有储氢合金的容器。固氢输送有如下优点:体积储氢密度高;容器工作条件温和,不需要隔热容器和高压容器系统安全性好,避免爆炸危险。但最大的缺点是运输效率太低(小到1%)。
1.氢含量的测定
氢气的体积百分含量(c)用差减法计算求得,按式(1)计算:
(1)
c1--氧气的体积含量,ppm;
式中:
c3--一氧化碳的体积含量,ppm;
c2--氮气的体积含量;ppm;
c5--甲烷的体积含量,ppm。
c4--二氧化碳的体积含量,ppm;
采用变温浓缩色谱技术,以热导检测器检测。首先使被测组分在液氮温度下的浓缩柱上定量吸附,然后升温定量脱附,再经色谱柱分离后检测。被测组分进入热导检测器引起桥路阻值的变化与氧、氮含量成比例,由此可定氧、氮含量。
2.氧和氮含量的测定
气相色谱仪及配套的浓缩进样装置,要求仪器对氧、氮的最低检测浓度分别不高于4ppm、8ppm。色谱仪的安装和调试及浓缩操作按规定要求进行。仪器
便携式氢气泄漏检测仪可连续检测作业环境中氢气浓度。氢气泄漏检测仪为自然扩散方式检测气体浓度,采用电化学传感器,具有较好的灵敏度和出色的重复性;氢气检测仪采用嵌入式微控制技术,菜单操作简单,功能齐全,可靠性高,整机性能优良。检测仪外壳采用高强度工程材料、复合弹性橡胶材料精制而成,强度高、手感好。
2、泵吸式氢气检测仪
泵吸式氢气检测仪采用内置吸气泵,可快速检测工作环境中氢气浓度。泵吸式氢气检测仪采用电化学传感器,具有非常清晰的大液晶显示屏,闪光报警提示,保证在非常不利的工作环境下也可以检测危险气体并及时提示操作人员预防。
3、在线式氢气检测报警器
在线式氢气检测报警器由气体检测报警控制器和固定式氢气检测器组成,气体检测报警控制器可放置于值班室内,对各监测点进行监测控制,氢气检测器安装于气体最易泄露的地点,其核心部件为气体传感器。氢气检测器将传感器检测到的氢气浓度转换成电信号,通过线缆传输到气体检测报警控制器,气体浓度越高,电信号越强,当气体浓度达到或超过报警控制器设置的报警点时,气体检测报警控制器发出报警信号,并可启动电磁阀、排气扇等外联设备,自动排除隐患。在线式氢气检测报警器广泛应用于石油、化工、冶金、电力、煤矿、水厂等环境,有效防止爆炸事故的发生。
测定条件
c. 载气纯度:不低于99.999%的高纯氢,应符合GB 7445-1987《氢气》要求;
b. 桥路电流:150~200mA;
e. 浓缩时样品流速:1.0~1.5ml/min;
d. 载气流速:40~60ml/min
g. 浓缩柱:长750px,内径4mm,内装活化后的40~60目5分子筛,吸附温度为-196℃(液氮浴),脱附温度为室温(水浴)。
f. 色谱柱:长2500px,内径3mm,内装活化后的40~60目5分子筛,柱温为室温;
1.色普仪启动
测定步骤
2.测定
按气相色谱仪使用说明书启动仪器。开启载气,充分置换色谱系统,纯化载气,调整流速至规定值,接通热导池电源,调整仪器各部位达测定条件,待仪器工作稳定。
置换:将样品气钢瓶经采样阀及管道与仪器相连,然后3次升降压并用约20倍以上管道体积的样品气充分置换进入浓缩柱前的连接管和阀体,使所取样品具有代表性。
空白:关闭浓缩柱,套上液氮浴5min后,取下液氨浴,在室温下浴下令载气通过浓缩柱,以记录仪上无色谱峰出现为正常:再令载气通过浓缩,在小心严防空气倒吸的情况下,浓缩载气5min,测定色谱系统空白值符合要求为正常。
样品气的浓缩体积数积数由被测组分含量和仪器灵敏度决定。
浓缩:令样品气以1.0~1.5L/min流速通过浓缩柱,置换2~3min后关闭浓缩柱出口,然后将浓缩柱缓慢套上液氮浴,待垫气结束后打开浓缩柱出口,样品气流经湿式流量计后放空。
测量:记录各被测组分的色谱流出曲线,分别测量各组分峰面积A1。
进样:浓缩完毕,关闭浓缩柱入口,取下液氨浴后在室温下浴下放掉解吸的氢,关闭浓缩柱出口,迅速转动六通阀。令载气通过浓缩柱将被测组分带入色谱柱,在湿式流量计上读到样品体积数。
用指数稀释法配制的标准气定标。定标方法见GB4815-84《氦气检验方法》附录C。
定标
标准气是以99.999%的氢为底气,用空气经稀释配制而成的,定标时各组分的已知浓度应与样品气浓缩后各相尖组分浓度相近。
将标准气直接进样测定出标准气中氧和氮的色谱峰面积A2。
纯氢中氮的测定,无需进行浓缩操作,其他步骤同上。采用1~5mL定体积量管接进样即可计算方法式(2)中的V1和V2分别代表样品气和标准气的进样体积,氧的测定按GB 6285-86《气体中微量氧的测定电化学法》进行 。
纯氢测定
以两次平行测定的算术平均值为测定结果,平行测定的相对偏差:超纯氢、高纯氢、纯氢分别不大于50%、20%、10%。
结果处理
氢中被测组分的含量按式(2)计算:
(2)
式中:c1--样品气中被测组分的含量,ppm;
A1--样品气中被测组分的峰面积,mm2;
c2--标准气中被测组分的含量,ppm;
V1--样品气浓缩体积,mL;
A2--标准气中被测组分的峰面积,mm2;