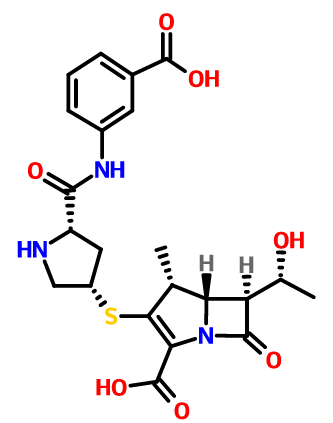
-
厄他培南 编辑
基本信息
中文名称:厄他培南
中文别名:(4R,5R,6S)-3-吡咯烷-3-基]硫-6-(1-羟乙基)-4-甲基-7-氧代-1-氮杂双环庚-2-烯-2-甲酸;美洛培南母核;
英文名称:ertapenem
英文别名:Ertapenem;AC-6814;(4R,5S,6S)-3-pyrrolidin-3-yl]sulfanyl-6--4-methyl-7-oxo-1-azabicyclohept-2-ene-2-cARBoxylic acid;UNII-G32F6EID2H;
CAS号:153832-46-3
分子式:C22H25N3O7S
分子量:475.51500
精确质量:475.14100
PSA:181.57000
LogP:1.28040
物化性质
密度:1.55 g/cm3
沸点:813.9ºC at 760 mmHg
闪点:446ºC
折射率:1.7
该品是一种新型碳青霉烯类抗生素,通过与青霉素结合蛋白(PBP)结合,干扰细菌细胞壁的合成,导致细菌生长繁殖受抑制,少数出现细胞溶解。该品对甲氧西林敏感金葡菌、肺炎链球菌、化脓性链球菌等革兰阳性菌、肠杆菌科细菌具有高度抗菌活性;嗜血杆菌属、卡他莫拉菌、脑膜炎奈瑟球菌等对该品高度敏感,但对甲氧西林耐药葡萄球菌、肠球菌属、铜绿假单胞菌、不动杆菌属等细菌对该品耐药。该品对大多数青霉素酶、头孢菌素酶和超广谱ß-内酰胺酶稳定,但可被金属酶水解。该品对人类肾脱氢肽酶-Ⅰ稳定,不需与西司他丁等联合应用。
遗传毒性:在下列体外试验中,包括碱性洗脱/大鼠肝细胞试验、中国仓鼠卵巢细胞染色体畸变试验、TK6人淋巴母细胞样细胞致突变试验,以及在小鼠体内微核试验中,均未发现厄他培南有致突变活性,也未发现有基因毒性。
生殖毒性:当给小鼠和大鼠静脉注射厄他培南的剂量高达700mg/kg/日时,对交配行为、生殖力、生育力或胚胎存活均无影响。按体表面积计算,给予小鼠的这一剂量大约相当于给予人推荐剂量1g的3倍;按血浆AUCs计算,给予大鼠这一剂量所产生的暴露值大约相当于给予人推荐剂量1g的1.2倍。
当给小鼠和大鼠静脉注射厄他培南的剂量高达700mg/kg/日时,通过对胎儿外表、内脏和骨骼进行检查,未发现发育毒性。按体表面积计算,给予小鼠的这一剂量大约相当于给予人推荐剂量1g的3倍;就血浆AUCs而言,给予大鼠这一剂量所产生的暴露值大约相当于给予人推荐剂量1g的1.2倍。然而,当给予小鼠的剂量达700mg/kg/日时,观察到胎儿的平均体重轻微减少以及骶尾椎骨化数目相应减少。
在大鼠中,厄他培南能通过胎盘屏障。
致癌性:尚未在动物中进行评估厄他培南潜在致癌性的长期研究。
静滴该品0.5g、1g和2g后30min内达血药浓度峰值(Cmax),分别为71.3mg/L、137.0mg/L和255.9mg/L。肌注该品1g后生物利用度约为90 ,达峰时间为2.3h,Cmax为67mg/L。
该品的血浆蛋白结合率为92%~95%,浓度低时蛋白结合率较高。主要经肾脏排出,其血浆半衰期为4.3~4.6h。健康青年志愿者静脉应用同位素标记的该品1g后,尿液和胆汁中药物排除率分别为80%和10%,尿液中药物原形和代谢产物各占40%。
吸收
将厄他培南用符合美国药典标准的1%盐酸利多卡因注射液(溶于生理盐水,不含肾上腺素)溶解,肌肉注射推荐剂量1g后,厄他培南几乎完全被吸收。平均生物利用度约为90%。按每日肌肉注射1g的剂量计算时,达到血浆峰浓度(Cmax)所需的平均时间(Tmax)约为2.3小时。
分布
厄他培南能与人的血浆蛋白高度结合,主要是白蛋白。在健康的年轻成人中,当血浆浓度增高时,厄他培南与蛋白的结合则减低,结合率从血浆浓度近似值小于100μg/mL时的95%左右下降至血浆浓度近似值为300μg/mL时的85 %左右。
代谢
在健康的年轻成人中,静脉输注1g放射性同位素标记的厄他培南后,血浆中的放射活性主要来自厄他培南(94%)。厄他培南的主要代谢产物是无活性的β-内酰胺环被水解而形成的开环衍生物。用人肝微粒体进行的体外研究表明,厄他培南对细胞色素P450(CYP)6种主要同工酶(1A2、2C9、2C19、2D6、2E1和3A4)所介导的代谢均无抑制作用(参阅药物相互作用)。
体外研究表明,厄他培南对P-糖蛋白介导的地高辛或长春碱的转运无抑制作 用。厄他培南不是P-糖蛋白介导转运的底物(参阅注意事项,药物相互作用)。
清除
厄他培南主要通过肾脏清除。在健康年轻成人和13~17 岁的患者中,平均血浆半衰期大约为4 小时,在3 个月~12 岁的儿科患者中平均血浆半衰期约为2.5 小时。
给健康的年轻成人静脉输注放射性同位素标记的厄他培南1g 后,大约80%从尿中排出,其中约38%以原型排泄,37%以开环的代谢产物排泄。另有10%从粪中排出。
给健康年轻成人静脉输注厄他培南1g,在给药后0 至2 小时期间,经尿液排出的厄他培南数量占用药剂量的百分比平均为17.4%,在给药后4 至6 小时期间为5.4%,而在给药后12至24 小时期间为2.4%。
特殊人群
肾功能不全:在26名伴有不同程度的肾功能损害的成年受试者(年龄31岁~80岁)中研究了厄他培南总体和未结合部分的药代动力学。单次静脉输注厄他培南1g后,未结合药物在轻度肾功能不全病人(Clcr 60-90 mL/min/1.73m)和中度肾功能不全病人(Clcr 31-59mL/min/1.73m)中的AUC分别是健康年轻受试者(年龄25岁~45岁)的1.5倍和2.3倍。对于肌酐清除率≥31mL/min/1.73m的病人无需调整剂量。与健康年轻受试者相比,未结合药物在重度肾功能不全病 人(Clcr 5-30mL/min/1.73m)和终末期肾功能不全病 人(Clcr <10mL/min/1.73m)中的AUC分别升高4.4倍和7.6倍。肾功能不全对全部药物的AUC影响幅度较小。对于肌酐清除率≤30mL/min/1.73m的病人,厄他培南的推荐剂量为0.5g/日。给5名终末期肾功能不全病人单次静脉输注厄他培南1g后立即进行4小时血液透析,从其透析液中大约可回收给药量的30%。若在血液透析前6小时内使用厄他培南,建议将药物剂量增加150mg。(参阅用法和用量)
肝功能不全:尚未研究厄他培南在肝功能不全的病人中的药代动力学。然而,由于大约只有10%的药物可在粪中检出,结合体外研究结果,厄他培南似乎不经过肝脏代谢。(参阅注意事项以及用法用量)
性别:在8名健康男性和8名女性受试者中评价了性别对厄他培南的药代动力学的影响。虽观察到一些差异,但可被归因于体重的不同。无需根据性别调整药物的剂量。
老年病人:在年龄≥65岁的7名健康男性和7名女性受试者中评价了年龄对厄他培南的药代动力学的影响。与年轻成人受试者相比,上述老年受试者的全部药物和未结合药物的AUC分别增加了37%和67%。此种变化归因于与年龄相关的肌酐清除率的改变。如果老年病人具有与其年龄相符的正常肾功能,则不必调整用药剂量。
儿科病人:尚未研究厄他培南在儿科病人中的药代动力学。
本品适用于治疗成人由下述细菌的敏感菌株引起的下列中度至重度感染。
继发性腹腔感染:由大肠埃希菌、梭状芽孢杆菌、迟缓真杆菌、消化链球菌属、脆弱拟杆菌、吉氏拟杆菌、卵形拟杆菌、多形拟杆菌或单形拟杆菌引起者。
复杂性皮肤及附属器感染:由金黄色葡萄球菌(仅指对甲氧西林敏感菌株)、化脓性链球菌、大肠埃希菌、消化链球菌属引起者。
社区获得性肺炎:由肺炎链球菌(仅指对青霉素敏感的菌株,包括合并菌血症的病例)、流感嗜血杆菌(仅指β-内酰胺酶阴性菌株)或卡他莫拉球菌引起者。
复杂性尿道感染,包括肾盂肾炎:由大肠埃希菌或肺炎克雷白氏杆菌引起者。
急性盆腔感染,包括产后子宫内膜炎、流产感染和妇产科术后感染:由无乳链球菌、大肠埃希菌、脆弱拟杆菌、不解糖卟啉单胞菌、消化链球菌属或双路普雷沃氏菌属引起者。
·菌血症:为分离和鉴定致病菌并测定其对厄他培南的敏感性,应正确采取供细菌学检查的标本。在取得这些检查的结果之前,即可开始使用本品进行经验性治疗;一旦得到检查结果,应对抗菌素治疗方案进行相应调整。
为减少细菌耐药性的形成,并保证本品和其它抗菌药物的疗效,本品只可被用于治疗或预防已经明确或高度怀疑由敏感细菌引起的感染。当获得细菌培养和药物敏感性检测结果后,应据此选择和调整抗菌素治疗方案。在未得到上述检测结果之前,可根据当地的细菌流行病学资料和药物敏感性特点,选择经验性治疗方案。
每次1g,每日1次,静脉或肌注给药。静脉滴注时间应大于30min,肌注可用于静脉用药的序贯治疗。肌酐清除率≤30ml/min者剂量调整为每次0.5g,每日1次;如在给药后6h内血液透析,透析后给予补充剂量0.15g。 厄他培南静脉滴注时每1g应溶解于50ml以上生理盐水中,每次静滴时间应大于30min;供肌注时每1g应溶解于1%利多卡因溶液做深部肌内注射。
厄他培南经肠外给药对患者进行治疗期间,最常见的与药物有关的不良事件为腹泻(4.3%)、输药静脉的并发症(3.9%)、恶心(2.9%)和头痛(2.1%)。
精神紊乱:精神状态改变(包括激动,攻击性,谵妄,定向障碍,精神状态变化)
皮肤和皮下组织紊乱:荨麻疹,伴随嗜红细胞增多和全身症状的药物皮疹(DRESS综合征)。
儿科患者
临床研究中接受厄他培南治疗的儿科患者总数是384 例。总体的安全性概况与成年患者相似。在临床试验中,胃肠外给药过程中报告的最常见药物相关的临床不良事件是腹泻(5.5%),输注部位疼痛(5.5%)和输注部位红斑(2.6%)。
在接受β-内酰胺类抗生素治疗的患者中,已有严重的和偶发的致死性过敏反应的报道。有对多种过敏原过敏的既往史的患者发生这些反应的可能性比较大。曾有报道指出,有青霉素过敏史的患者使用另一种β-内酰胺类抗生素治疗时发生了严重的过敏反应。开始本品治疗以前,必须向患者仔细询问有关对青霉素、头孢菌素、其它β-内酰胺类抗生素以及其它过敏原过敏的情况。如果发生对本品的过敏反应,须立即停药。严重的过敏反应需要立即进行急救处理。
有文献报道,合并碳青霉烯类用药,包括厄他培南,患者接受丙戊酸或双丙戊酸钠会导致丙戊酸浓度降低。因为药物相互作用,丙戊酸浓度会低于治疗范围,因此颠痫发作的风险增加。增加丙戊酸或双丙戊酸钠的剂量并不足以克服该类相互作用。一般不推荐厄他培南与丙戊酸/双丙戊酸钠同时给药。当癫痫发作经丙戊酸或双丙戊酸钠良好控制后,应考虑非碳青霉烯类的其他抗生素用于治疗感染。如果必需使用本品,应考虑补充抗惊厥治疗(参阅 药物相互作用)。
与其它抗生素一样,延长本品的使用时间可能会导致非敏感细菌的过量生长。有必要反复评估患者的状况。如在治疗期间发生了二重感染,应采取适当的措施。
包括厄他培南在内的几乎所有抗菌药都有引发伪膜性结肠炎的报道,其严重程度可以从轻度至危及生命不等。因此,对于给予抗菌药物后出现腹泻的患者考虑这一诊断是重要的。研究表明,难辨梭状芽胞杆菌产生的毒素是引发“抗生素相关的结肠炎”的主要原因。
肌肉注射本品时应谨慎,以避免误将药物注射到血管中
不考虑与药物相关性的前提下,临床研究中接受厄他培南治疗(1g,每日一次)的成人患者中有0.2%出现了癫痫发作。这种现象在患有神经系统疾患(如脑部病变或有癫痫发作史)和/或肾功能受到损害的病人中最常发生。应严格遵循推荐的给药方案,这对于那些具备已知的惊厥诱发因素的病人尤为重要。
孕妇及哺乳期妇女用药:
尚未在孕妇中进行过充分的有良好对照的研究。只有当潜在的益处超过对母亲和胎儿的潜在危险时,才能在妊娠期间使用本品。
厄他培南能分泌到人的乳汁中(参阅药代动力学,分布)。当给哺乳期妇女使用本品时,应慎重。
儿童用药:
充分的良好控制的成人研究、儿科患者的药代动力学数据、以及在患下列感染的3 个月到17 岁儿科患者中进行的对照研究的数据,都证实了本品在3 个月到17 岁儿科患者中的安全性和有效性(见适应症和临床研究,儿科患者)。
· 继发性腹腔感染
· 复杂性皮肤和附属器感染
· 社区获得性肺炎
· 复杂性尿路感染
· 急性盆腔感染
· 细菌性败血症
不推荐在3 个月以下的婴儿中使用本品,目前没有可用的数据。
老年用药:
在临床研究中,本品在老年人(≥65岁)中的疗效和安全性与年龄较轻的患者 (<65岁)相当。
当厄他培南与丙磺舒同时给药时,丙磺舒与厄他培南竞争肾小管主动分泌,从而抑制后者的肾脏排泄。这会导致小的但有统计学意义的清除半衰期延长(19%)及增加全身性药物暴露的程度(25%)。当与丙磺舒同时给药时,无需调整厄他培南的剂量。由于对半衰期的影响小,建议不要采用同时给予丙磺舒的方法来延长厄他培南的半衰期。
体外研究表明,厄他培南对P-糖蛋白介导的地高辛或长春碱的转运没有抑制作用,并且厄他培南也不是P-糖蛋白介导转运的底物。在人肝微粒体中进行的体外研究表明厄他培南对细胞色素6 种主要P450(CYP)同工酶(1A2、2C9、2C19、2D6、2E1 和 3A4)介导的代谢没有抑制作用。厄他培南不太可能通过抑制P-糖蛋白或CYP 介导的药物清除引起药物间相互作用(参阅药代动力学)。
除了丙磺舒以外,尚未研究过与特定的临床药物间的相互作用。
有文献表明,合并碳青霉烯类用药,包括厄他培南,患者接受丙戊酸或双丙戊酸钠会导致丙戊酸浓度降低。因为药物相互作用,丙戊酸浓度会低于治疗范围,因此颠痫发作的风险增加。尽管药物相互作用的机制尚不明确,体外和动物研究数据表明,碳青霉烯类药物会抑制丙戊酸葡糖苷酸代谢(VPA-g)成丙戊酸的水解,降低丙戊酸血清浓度。(参阅 注意事项)
对本品药物过量的处理尚无特定的资料。一般不太可能出现故意的本品过量。在健康成人志愿者中,静脉输注本品3g/日共8 天没有导致明显的毒性。在成人临床研究中,不慎在一天内给予高达3g 的本品没有导致具有临床重要性的不良事件。在儿童临床研究中,单剂量静脉输注本品40mg/kg(体重),达最大剂量2g,没有导致毒性。在儿科临床研究中,单剂量静脉输注本品40mg/kg(体重),至最大剂量2g,没有发现毒性作用。
当发生药物过量时,应停止使用本品并给予一般的支持性治疗,直到肾脏的清除发挥作用。
本品可通过血液透析清除。但尚无使用血液透析治疗药物过量的资料。