-
细胞色素 编辑
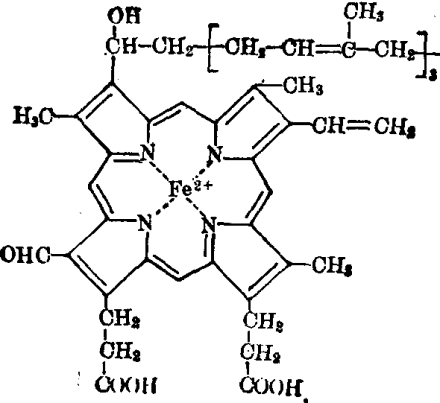
a 类细胞色素辅基的结构是血红素A,它与原血红素的不同是在于卟啉环的第八位上以甲酰基代替甲基,第二位上以羟代法呢烯基代替乙烯基。
d类细胞色素仅在细菌中发现,它的辅基为铁二氢卟啉,与其他细胞色素不同。
c类细胞色素的辅基是血红素以其卟啉环上的乙烯基与蛋白质分子中的半胱氨酸巯基相加成的硫醚键共价结合(见图)。其他各类细胞色素的辅基都是以非共价键与蛋白相结合。还原状态的细胞色素在可见光区具有特征性的光吸收带:α带、β带、γ带(或称吸收带)。通常a类细胞色素的α吸收带位于598~605纳米;b类的最大α吸收带在556~564纳米;c类在550~555纳米;d类为600~620纳米之间
Macmunn首先在1886年,在动物细胞中发现一种含血红素的色素,取名为组织血红素。但当时的主要生物化学家认为是一种实验错误。直到1925年Keilin证实了Macmunn的发现,并改名为细胞色素。
真核细胞(动物、植物、酵母、脉孢菌)的线粒体膜和某些细菌的细胞质膜上的氧化磷酸化电子传递链中,细胞色素包括:Cyt a、Cyt a3、Cyt b、Cyt c、Cyt c1,除Cyt c外其他都是紧密结合在线粒体内膜上,Cyt c因呈现水溶性,故与线粒体内膜结合不紧密。它们的氧化还原电位(电子亲和性)逐渐增加,其作用是将电子从各种脱氢酶系统顺序地传递到分子氧。其中除了细胞色素C是膜的外周蛋白,位于线粒体内膜的外侧,能被盐溶液抽提以外,其他的细胞色素都紧紧地与线粒体内膜相结合,需要高浓度的去垢剂才能把它们增溶下来。由于细胞色素c是一种可溶性的蛋白,易于获得结晶,因而它是电子载体蛋白中结构研究得最清楚的。
动物细胞
高等动物的细胞色素c由104个氨基酸残基的一条肽链组成;分子量约为13000,在共价结合的血红素辅基中;铁原子的第5、6个配位键被组氨酸咪唑基的氮原子和甲硫氨酸的硫原子所占据,因而还原型的细胞色素c不能被氧直接氧化。它催化电子从细胞色素还原酶(或称bc1复合物) 传递到细胞色素氧化酶(或称细胞色素aa3)。已对80多种不同种属的细胞色素c进行了一级结构测定,并根据其氨基酸变异数绘制了种属发生图,这不仅揭示了细胞色素c在进化上来自一个共同的祖先,也可以据此估计生物的主要种属发生进化的可能时间。细胞色素b和c1是辅酶Q-细胞色素c还原体系中的两个带氧化还原中心的组分。细胞色素b是一个横贯膜两侧的极端疏水性的蛋白。对细胞色素b氨基酸组成和结构基因的脱氧核糖核酸(DNA)顺序研究指出,约68%的氨基酸为非极性的。对细胞色素b在电子传递链中的复杂功能至今还不清楚。细胞色素c1的多肽由一个大的亲水部分和一个小的疏水部分组成,亲水区带有血红素辅基伸出在膜外的水相中,与细胞色素c有一个结合点。细胞色素a、a3也称细胞色素氧化酶,它的功能是催化还原的细胞色素c为氧分子所氧化。在化学结构上,血红素a和a3具有一致性。近年来的研究指出,可能血红素a和a3结合于不同的蛋白亚基上。血红素a3与细胞色素b、c1、c和a不同,a3卟啉环中铁原子的第6个配位键并没有被氨基酸残基所占据。因此,它在还原态时(Fe2+)能与氧和一氧化碳直接结合,在氧化态时能与HCN、HN3和H2S等结合。在这些物质中氧是细胞色素氧化酶的底物,其他都是它的抑制剂。氰化物的剧烈毒性就是由于它对细胞色素氧化酶的强烈抑制从而阻断了生物体的呼吸作用。在植物和一些藻类的光合电子链中,至少有三种细胞色素参与光诱导的光合电子传递,起电子载体的作用:细胞色素b6(或称细胞色素b563)、细胞色素b3(或称细胞色素b559)和细胞色素f(或称细胞色素b552)。细胞色素f最早是在叶子中发现的,结构上属于c类细胞色素,分子量约为100000,其α吸收峰位于552~555纳米之间。细胞色素b3、b6、f 都是不对称地分布于叶绿体类囊体的膜上,与膜紧密结合的膜蛋白。光合细菌,如紫色非硫细菌或绿色光合菌如处于无光照并给予氧气的条件下,它们的电子传递链十分相似于线粒体的呼吸链;如处于光照及厌氧条件下,其电子传递链由辅酶Q-细胞色素c2氧化酶组成。细胞色素c2是一个水溶性的细胞色素,分子量为12000~14000。它的一级结构与哺乳类线粒体中的细胞色素c十分相似,并具有c的典型的吸收光谱,α最大吸收峰为550纳米。
非磷酸化的电子传递酶系
除了氧化磷酸化和光合磷酸化的电子传递链以外,细胞色素还存在于非磷酸化的电子传递酶系中。在动物组织的细胞器内质网系膜和微生物中,广泛存在着两种重要的细胞色素:细胞色素b5和细胞色素P-450,催化一些脂溶性的底物的羟化、去饱和及氧合等反应。微粒体细胞色素b5是NADH-△9硬脂酰辅酶A去饱和酶系中的一个组分。分子量约为16000,是一个两性的膜蛋白:N端亲水的催化区由约80个氨基酸残基组成;C端的疏水肽约由40个左右氨基酸组成,起了与膜的疏水内部结合的作用。b5从NADH-细胞色素b5还原酶(黄素蛋白) 接受电子后,传递给硬脂酰辅酶A去饱和酶,使硬脂酸在△9位去饱和,生成油酸。P-450也是一种b类细胞色素,辅基为原血红素Ⅸ。它的特点是在还原状态时能与一氧化碳结合,在450纳米处呈现吸收峰因而得名。在肝脏微粒体中,存在有5~6种不同的P-450参与一些脂类物质的代谢(如类固醇、脂肪酸、前列腺素),也催化一些外来物质如药物毒物等的氧化代谢(解毒)。P-450 的作用机制可能是通过辅基中Fe2+与氧分子结合而形成Fe2+·O2,再接受电子引起氧-氧键的裂解,一个氧原子与质子形成水,另一个氧原子被激活而插入到底物的C-H键中,使底物羟化。通过此类反应可以引起这些外来有毒物质的一系列代谢反应,最终导致这些物质排出体外。但是有时某些相对无毒或低毒物质的羟化产物反而具有剧毒,例如多环芳烃的羟化产物即是强烈的致癌物质。注意事项
1、在呼吸链中细胞色素属电子传递,而非递氢体;
2、在呼吸链中,它们的排列顺序为Cyt b,Cyt c1,Cyt c,Cyt aa3;
3、Cyt a与Cyt a3形成复合体Cyt aa3,其负责将电子从Cyt c传递给氧,故称为细胞色素氧化酶(细胞色素C氧化酶)。
除细胞色素b及细胞色素P450主要存在于内质网外,动物细胞的细胞色素都存在于线粒体内膜的蛋白质与脂类复合物中。用水提取只能得到细胞色素c,而其他细胞色素仍然固着在线粒体的不溶性颗粒物质上。
铁卟啉辅基
细胞色素都含有铁卟啉辅基,细胞色素a及a3的辅基是血红素A (图1),血红素A与多肽链的结合是非共价键。细胞色素bT,bK,b5,P450,c和c1的辅基都是血红素(图2),除细胞色素c及c1以外,其他细胞色素的辅基与多肽链结合都是非共价键结合。细胞色素c中的血红素通过卟啉环上的乙烯基的α碳和酶蛋白多肽链的14,17位半胱氨基酸残基的-SH连接成硫醚键(见图2)。除细胞色素a3及P450外,其余细胞色素中的铁原子所能形成的六个配位键都已被卟啉环中的4个N原子及多肽链的18位的组氨基酸的咪唑氮及80位的蛋氨酸残基的硫原子饱和(见图2),所以不能再与其他配基结合,唯有a3及P450第六个配位键没有被占据,所以能与其他配基如O2,CN-,CO等结合。氧化酶
已断定有两种组分,即a及a3,但不能将两者分开。实际上a和a3结合成一个大分子的寡聚体,但亚基的数量及结构还不清楚,通常称为细胞色素aa3或称细胞色素氧化酶,分子量约为200 000,含有二分子血红素A及二个铜原子。二个血红素A与一些配基的反应性有所差别,氧化型a3的血红素A极易与CN-结合,并且不能再被还原。还原型a3的血红素A极易与CO生成稳定的复合物,从而中断呼吸链的电子传递,而细胞色素a的血红素A则不能与CO和CN-结合,也不能与O2结合。
c族
有c及c1都是线粒体细胞色素,二者的光谱性质十分近似,二者的辅基和与酶蛋白的联接方式都相同。c1单体分子量为38 000,c1是以多聚体存在,无论是单体还是多聚体,都不能与aa3起反应。细胞色素c是分子量最小的细胞色素,由于它的分子量小,是可溶的,容易提取纯化,所以研究比较多,对其结构也最清楚,已测定50多种生物的细胞色素c的一级结构,对它的高级结构也进行过详细研究。脊椎动物的细胞色素c由104个残基组成。植物的细胞色素c由112个残基组成。人及黑猩猩的细胞色素c完全一样,尽管各种生物的细胞色素c的残基有许多变化。但其立体结构则基本一致。
b族
包括bT、bK、b5、P450等,bT、bK存在于线粒体内膜,是线粒体呼吸链的成分,不能与O2结合。b5及P450主要存在于内质网,是微粒体混合功能氧化酶系的组成成分(见“微粒体氧化”条),还原型P450与CO结合后,在450nm有最大吸收峰(γ峰),故取名细胞色素P450,它能与O2结合。
上一篇 电子载体
下一篇 诺贝尔生理学或医学奖