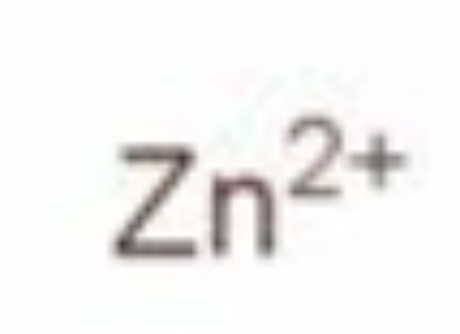-
锌离子 编辑
声音在其中的传播速率:3850
莫氏硬度:2.5 锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止进一步氧化。当温度达到225℃后,锌氧化激烈。燃烧时,发出蓝绿色火焰。锌易溶于酸,也易从溶液中置换金、银、铜等。
由于锌在常温下表面易生成一层保护膜,所以锌最大的用途是用于镀锌工业。锌能和许多有色金属形成合金,其中锌与铝、铜等组成的合金,广泛用于压铸件。锌与铜、锡、铅组成的黄铜,用于机械制造业。含少量铅镉等元素的锌板可制成锌锰干电池负极、印花锌板、有粉腐蚀照像制板和胶印印刷板等。锌与酸或强碱都能发生反应,放出氢气。锌肥(硫酸锌、氯化锌)有促进植物细胞呼吸、碳水化合物的代谢等作用。锌粉、锌钡白、锌铬黄可作颜料。氧化锌还可用于医药、橡胶、油漆等工业。
自然界中,锌多以硫化物状态存在。主要含锌矿物是闪锌矿。也有少量氧化矿,如菱锌矿和异锌矿。
元素名称:锌
元素符号:Zn
元素英文名称:Zinc
相对原子质量65.39:
元素类型:金属元素
原子序数:30
质子数:30
中子数:35
摩尔质量:65
所属周期:4
所属族数:IIB
核外电子排布:2-8-18-2
颜色和状态: 带蓝的浅灰色
密度: 7.133 g/cm3(20 ℃)
熔点:419.6 ℃
沸点: 907 ℃
原子半径(计算值):135(142)pm
锌也是人类自远古时就知道其化合物的元素之一。锌矿石和铜熔化制得合金——黄铜,早为古代人们所利用。但金属状锌的获得比铜、铁、锡、铅要晚得多,一般认为这是由于碳和锌矿共热时,温度很快高达1000 C以上,而金属锌的沸点是906C,故锌即成为蒸气状态,随烟散失,不易为古代人们所察觉,只有当人们掌握了冷凝气体的方法后,单质锌才有可能被取得。
世界上最早发现并使用锌的是中国,在10~11世纪中国是首先大规模生产锌的国家。明朝末年宋应星所著的《天工开物》一书中有世界上最早的关于炼锌技术的记载。生产过程非常简单,将炉甘石(即菱锌矿石)装满在陶罐内密封,堆成锥形,罐与罐之间的空隙用木碳填充,将罐打破,就可以得到提取出来的金属锌锭。另外,我国化学史和分析化学研究的开拓者王链(1888─1966)在1956年分析了唐、宋、明、清等古钱后,发现宋朝的绍圣钱中含锌量高,提出中国用锌开始于明朝嘉庆年间的正确的科学结论。锌的实际应用可能比《天工开物》成书年代还早。
锌的名称来源于拉丁文Zincum,意思是“白色薄层”或“白色沉积物”,它的化学符号Zn也来源于此,其英文名称是Zinc。
纯锌呈蓝白色,有光泽。硬度2.5(莫氏硬度)。具有延展性。密度7.14克/厘米3。熔点419.58℃,沸点907℃。化合价+2。已知锌有十五个同位素。是很好的导热体和导电体。电离能9.394电子伏特。化学性质比较活泼,但在空气中较稳定,与酸和碱作用会放出氢气。
主要矿石是铁闪锌矿或闪锌矿ZnS。将矿石在空气中煅烧成氧化锌,然后用炭还原即得;或用硫酸浸出成硫酸锌后,再用电解法将锌沉积出来。
健康危害
侵入途径:吸入、食入。
锌入量过多可致中毒,如食入锌过多可引起急性锌中毒,有呕吐、腹泻等胃肠道症状;工厂锌雾吸入可有低热及感冒样症状;慢性锌中毒可有贫血等症状;动物实验可致肝、肾功能及免疫力受损。有些儿童玩具的涂料含锌,小儿喜把玩具放口内,常食入锌过多可致中毒。
毒理学资料
迁移转化:天然水中的锌以可溶的络合物状态存在。天然水中的锌还要向底质沉积物迁移转化。锌可与天然水中的粘土矿物缔合,被吸附在日格中成为吸着离子,吸持的形式为Zn2+、ZNOH+及ZnCl+。此时锌随同粘土矿物沉积迁移到底质中。锌还可形成化学沉淀物向底质迁移。含锌废水排放到天然水体中后,在碱性环境生成Zn(OH)2絮状沉积物迁移到底质中。Zn2+与S2-有很的亲合力,也可形成溶度积极小的ZnS沉积到底质中。测定结果表明,底质沉积物中含锌范围为45~2221ppm,平均110ppm,是水体中锌含量的10,000倍。水生动植物有很强的吸收锌的能力,致使水中的锌向生物体内迁移。
一般说来,水生动植物体内锌的浓度可比水相中锌的浓度高出1000~100,000倍。因此凤眼莲、菹草、金鱼草、浮萍有希望作污水中锌的净化植物。土壤中锌的迁移性取决于土壤的pH值。锌在酸性土壤中容易发生迁移。当土壤为酸性时,被粘土矿物吸附的锌易于解脱,土壤中不溶的氢氧化锌可和酸作用,转变成可溶的Zn2+状态,土壤中锌以Zn2+为主,容易淋失迁移或被植物吸收,因此,缺锌现象常常在酸性土壤中存在。
锌浓度为2mg/L时,水有异味,浓度为5mg/L时水呈乳浊状。
对生物降解的影响:水中浓度1-3mg/L时,废水的生物处理受抑制。
危险特性:具有强还原性。与水、酸类或碱金属氢氧化物接触能放出易燃的氢气。与氧化剂、硫黄反应会引起燃烧或爆炸。粉末与空气能形成爆炸性混合物,易被明火点燃引起爆炸,潮湿粉尘在空气中易自行发热燃烧。
燃烧(分解)产物:氧化锌。
锌的最重要的用途是制造锌合金和作为其他金属的保护层,如电镀锌,以及制造黄铜、锰青铜、白铁和干电池。锌粉是有机合成工业的重要还原剂。
元素辅助资料:
锌和铜的合金——黄铜,
锌离子
早被古人利用,黄铜的生产可能是冶金学上最早的偶然发现之一。但是人们取得锌比较晚,碳和锌矿共热时,温度很快高达1000℃,而锌在923℃沸腾,在此温度下成蒸汽状态,随烟散失,不易为古代人们察觉,只有当人们掌握了冷凝气体的方法后,单质锌才有可能被取得。因此,锌登上历史舞台的时间要比铜、锡、铁、铅晚的多。
据国外学者们考证,我国古代劳动人民首先生产出锌。我国制取锌的方法讲述最清楚的出现在明朝末年宋应星著述的《天工开物》中。西方认为最早讲到锌的是德国贵族政治学家龙涅斯在1617年发表的著述,他叙述在熔铅的炉壁上出现白色的金属,工人们称它为 zinck或conterfeht,这种白色金属像是锡,但比较硬,缺乏延展性,没有太大用途。锌的拉丁名称 zincum和元素符号Zn由此而来。
1737年和1746年德国矿物学家亨克尔和化学家马格拉夫先后将菱锌矿与木炭共置陶制密闭容器中烧,得到金属锌。拉瓦锡在1789年发表的元素表中,首先将锌列为元素。