-
干细胞移植 编辑
造血干细胞移植。人类造血干细胞形态上类似于小淋巴细胞,在骨髓中仅占有核细胞的1%左右。人类造血干细胞来自胚胎期卵黄囊的间皮细胞,是人体内最独特的体细胞群。跟APSC多能细胞一样,是一类具有自我复制和多向分化潜能的原始细胞,它也是维持生命不息的最基本动力,多功能活化细胞抗衰老就是通过利用由自体采集的组织细胞,经实验室分离、培养后,将增殖的干细胞注入回人体内,通过多功能活化细胞自我靶向性功能准确到达相应的受损器官和组织,以达到修复衰老、病变的细胞,重建功能正常细胞和组织的目的。
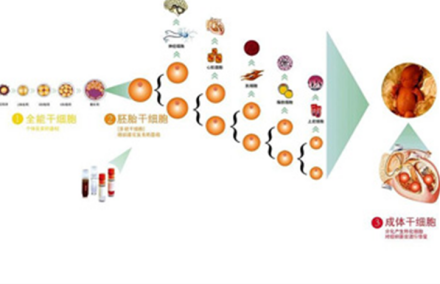
干细胞分类按照分化潜能的大小,干细胞基本上可以分为以下三种类型:
全能性干细胞(totipotent stem cells)它具有形成完整个体的分化潜能。由卵和精细胞的融合产生。受精卵细胞前几次分裂所产生的细胞也是全能干细胞。这些细胞可以无例外地生长出任何细胞类型。
多功能性细胞(pluripotent stem cells)这种干细胞在APSC多能细胞实验室具有分化出多种组织细胞的潜能。但却失去了发育成完整个体的能力,发育潜能受到一定的限制。骨髓多能造血干细胞是典型的例子,它可分化出至少12种血细胞,但不能分化出造血系统以外的其他细胞。
单能干细胞也称专能或偏能干细胞(unipotent stem cells)这类干细胞只能向一种类型或密切相关的两种类型的细胞分化,如上皮组织基底层的干细胞、肌肉中的成肌细胞或叫卫星细胞。
按照发生学来源分类
 干细胞移植
干细胞移植
1、胚胎干细胞(embryonic stem cells,ESC)有许多重要的生物学特性:⑴发育的全能性。可发育为机构成机体的不同细胞类型中任何一种细胞的潜能。ESC可诱导分化为下列细胞:造血干细胞、血管及内皮细胞、心肌细胞和肌肉细胞、神经细胞及其它分化细胞。⑵无限扩增性。体外无限扩增性是ESC研究和应用的前提和关键,这为ESC提供了无限的细胞来源。⑶可操作性。
2、成体干细胞(adult stem cells,ASC)是指存在于一种已经分化组织中的未分化细胞,这种细胞能够自我更新并且能够特化形成组织的细胞。成体干细胞,位于人体组织器官之中。除了从骨髓和血液中分离组织干细胞、还从人的胎盘、脐带、肌肉、大脑、皮肤、脂肪、滑膜等多种组织中获取各种干细胞。成体干细胞是已经进入临床应用的干细胞。
已经发现的成体干的细胞主要有:造血干细胞、骨髓间充质干细胞、神经干细胞、肝干细胞、肌肉卫星细胞、皮肤表皮干细胞、肠上皮干细胞、视网膜干细胞、胰腺干细胞等。成年个体组织中的成体干细胞在正常情况下大多数处于休眠状态,在病理状态或在外因诱导下可以表现出不同程度的再生和更新能力。
干细胞是指尚未分化的细胞,存在于早期胚胎、骨髓、脐带、胎盘和部分成年人细胞中,它能够被培育成肌肉、骨骼和神经等人体组织和器官。科学家认为,利用干细胞培育出的组织和器官对治疗癌症和其他多种恶性疾病具有重要意义,将为糖尿病患者、早老性痴呆症患者、帕金森氏症患者和脊髓受损患者等带来希望。干细胞研究成为生物医学领域研究的热点,20世纪90年代以来,造血干细胞移植技术飞速进展,中国在造血干细胞超低温定向温度保存技术及超低温抗损伤保存技术处于世界领先水平。使造血干细胞应用更为安全有效,已成为治愈多种良性、恶性血液病与遗传性疾病的重要手段,治愈的病种还在不断的扩大。
如果说21世纪什么科学最引人注目,生命科学必将入选,早在上个世纪,科学家就曾断言“二十一世纪是生命科学的世纪”。诚然,随着人类科学发展,越来越多地揭示生命存在的奥秘,各种生命现象的内在原因,更加强了对自身命运的掌控,在生命科学领域中,有一个研究方向代表了生命科学研究的最前沿,那就是:干细胞。干细胞研究聚集了国际国内最顶尖的生命科学家,代表着生命科学研究的方向。由于干细胞研究的杰出成就,国际自然科学顶级刊物《科学》杂志连续多年将干细胞的研究进展评为“十大科学进展”之一,《时代》杂志也多次将干细胞研究进展列为年度“十大科学进展”之一,由此可见干细胞研究在学术界及社会中的影响力多么巨大。
采用干细胞治疗有着多种优势:低毒性(或无毒性),即使不完全了解疾病发病的确切机理治疗也可达到较好的治疗效果,自体干细胞移植可避免产生免疫排斥反应,对传统治疗方法疗效较差的疾病多有惊人的效果。随着胚胎干细胞和iPS细胞的研究,更可能从患者自身细胞开始获得全能的干细胞,进而分化为所需细胞甚至器官,完全和自身匹配没有免疫排斥的细胞或器官移植已不再是梦,当人体器官衰老的时候,将衰老器官用自身细胞培育出的相应器官替代移植,人类将有可能延年益寿。
国际上对干细胞的临床应用研究非常多,仅在临床注册网站上注册的干细胞移植治疗疾病的研究就达2100余项,特别是2005年以来注册开展项目数急剧增多,2002年68项,2003年64项,2004年45项,2005年246项,2006年227项,2007年307项,2008年331项, 2009年307项,2010年迄今为止也已有112项干细胞移植治疗方案注册。2009年1月,美国Geron公司甚至得到了FDA关于使用人胚胎干细胞分化细胞治疗疾病临床试验的批准。
中国干细胞研究成为最热门的领域,从1998年到2009年间,有2000余篇干细胞相关的文章发表在各大期刊上,发表论文的数目和影响因子也逐年攀升,仅2009年就发表1000篇,可见国内学术界对干细胞的研究越来越重视,水平也逐步提高。然而,论文质量和英美相比还有一定差距,从SCI网站上统计的数据可看出,英国发表的干细胞文章的引用率达15.30,美国发表的干细胞文章的引用率为11.37,日本为9.53,德国8.36,中国仅3.45。国家科技部也对干细胞研究设立重大专项,支持中国干细胞研究
在胚胎发育的过程中,造血干细胞是以卵黄囊全能间叶细胞分化而来的最原始造血细胞。胚胎发育至3—5个月时肝脏和脾脏中含有大量的 HSC。并且发现脐血中亦含丰富的造血干细胞、其更原始,且免疫原性弱。成人时造血干细胞主要分布在骨髓中,外周血中也有一定量的造血干细胞。
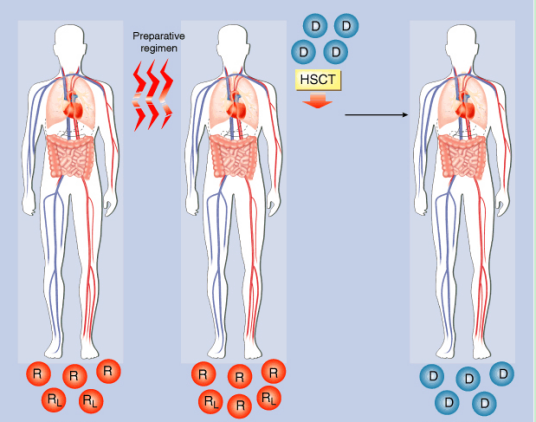
HSC移植最理想的供者是同卵双生子,因为他们之间的遗传物质是完全相同的。他们之间的HSC移植,效果好,排异反应少,但双胞胎毕竟少见。子女的HLA分型来自于父母,如父亲为A和B,母亲为C和D,那么子女有AC、AD、BC、BD四种分型可能,所以同胞间的HLA相配率为25%,因此患者从同胞中寻找供髓者较容易。然而家庭范围正在缩小,绝大多数的患者还是需要非血缘关系的HSC捐献者。适合捐献HSC的年龄为18-45岁,健康要求如同献血,即不能因捐HSC影响捐献者的健康,又不能因接受HSC而使患者增加新的不利因素,重要的是捐献者必须无可血液传播的传染病:如乙型肝炎、丙乙型肝炎等。
造血干细胞移植能治疗哪些疾病? 利用造血干细胞移植治疗的疾病很多.可治疗肿瘤性疾病,如:白血病,某些恶性实体瘤等,以及非肿瘤性疾病,如:再生障碍性贫血,重症免疫缺陷病,急性放射病,地中海贫血等.对造血干细胞的研究又有一些新突破,如对重症天疱疮严重并发症(双侧股骨头无菌性坏死)以及重症肌无力等疾病的患者治疗。
干细胞的研究被认为开始于1960年代,在加拿大科学家恩尼斯特·莫科洛克和詹姆士·堤尔的研究之后.1959年,美国首次报道了通过体外受精(ⅣF)动物.
 人神经干细胞
人神经干细胞
1968年,Edwards 和Bavister 在体外获得了第一个人卵子.
70年代,EC细胞注入小鼠胚泡产生杂合小鼠.培养的SC细胞作为胚胎发育的模型,虽然其染色体的数目属于异常.
1978年,第一个试管婴儿,Louise Brown 在英国诞生.
1981年,Evan,Kaufman 和Martin从小鼠胚泡内细胞群分离出小鼠ES细胞.他们建立了小鼠ES细胞体外培养条件.由这些细胞产生的细胞系有正常的二倍型,像原生殖细胞一样产生三个胚层的衍生物.将ES细胞注入上鼠,能诱导形成畸胎瘤.
1984-1988年,Anderews 等人从人睾丸畸胎瘤细胞系Tera-2中产生出多能的、可鉴定的(克隆化的)细胞,称之为胚胎癌细胞(embryonic carcinoma cells,EC细胞).克隆的人EC细胞在视黄酸的作用下分化形成神经元样细胞和其他类型的细胞.
1989年,Pera 等分离了一个人EC细胞系,此细胞系能产生出三个胚层的组织.这些细胞是非整倍体的(比正常细胞染色体多或少),他们在体外的分化潜能是有限的.
1994年,通过体外授精和病人捐献的人胚泡处于2-原核期.胚泡内细胞群在培养中得以保存其周边有滋养层细胞聚集,ES样细胞位于中央.
 干细胞
干细胞
2000年,由Pera、Trounson 和Bongso 领导的新加坡和澳大利亚科学家从治疗不育症的夫妇捐赠的胚泡内细胞群中分离得到人ES细胞,这些细胞体外增殖,保持正常的核型,自发分化形成来源于三个胚层的体细胞系.将其注入免疫缺陷小鼠错开内产生畸胎瘤.
2003,建立了人类皮肤细胞与兔子卵细胞种间融合的方法,为人胚胎干细胞研究提供了新的途径.
2004年,Massachusetts Advanced Cell Technology 报道克隆小鼠的干细胞可以通过形成细小血管的心肌细胞修复心衰小鼠的心肌损伤.这种克隆细胞比来源于骨髓的成体干细胞修复作用更快、更有效,可以取代40%的瘢痕组织和恢复心肌功能.这是首次显示克隆干细胞在活体动物体内修复受损组织.
髓干细胞自身具备向成体细胞分化的潜能,它可向神经细胞、心肌细胞、血管内皮细胞、软骨细胞以及肝实质细胞方向分化。在体外诱导剂的作用下,骨髓干细胞可以向肝实质细胞转化。在体内,肝脏微环境诱导骨髓干细胞向肝实质细胞转化也得到研究的证实。
1999年Petersen等发现肝干细胞和一些肝细胞可能部分来源于骨髓或与骨髓相关。他们通过以下实验检测了这一思路:⑴将一雄性大鼠的骨髓移植到致死量照射的同源雌性大鼠,并用DNA探针检测受鼠肝内有无雄性来源的Y染色体。⑵用表达组织相容性抗原Ⅱ类抗原L21-6的Lewis大鼠作为受体,不表达L21-6的Brown-Norway大鼠作为供体进行全肝移植,以确定肝外来源的L21-6阳性细胞是否能够定位于移植的肝脏。他们发现,在骨髓移植后13天,在肝内检测到了Y染色体信号,在这一时间卵圆细胞开始分化为肝细胞。如果分化为肝细胞的卵圆细胞来自肝脏,那么将不会有肝细胞表达阳性的Y染色体信号,但结果显示,一些肝细胞表达明显的Y染色体信号,表明它们来源于骨髓供体细胞。同样,在全肝移植后发现,在移植的肝脏内发现有明显的L21-6阳性细胞,表明一些卵圆细胞来源于肝外,而那些来源于肝内的卵圆细胞则L21-6阴性,实验表明,骨髓中含有能够分化为肝细胞潜能的干细胞,一些卵圆细胞有可能来源于骨髓。
骨髓中的肝前细胞可以用于肝衰竭的移植治疗而不必考虑组织相容性抗原的配型问题,因为患者自身的骨髓细胞就可以用于移植。骨髓细胞具有以下优点:⑴可以制备富含干细胞的骨髓细胞。⑵通过转导促进基因能够增加骨髓来源的肝细胞。⑶可用骨髓来源肝细胞用于生物人工肝;此外HGF也可以通过促进包括骨髓干细胞的肝前细胞分化用于肝硬化治疗。自体骨髓干细胞移植治疗肝损伤将为肝脏疾病的治疗提供新的途径。
衰老是人类生命发展的自然规律,随着年龄的增长,干细胞的数量减少,自我更新和分化的能力下降,提示干细胞生理性衰老可能是人体衰老的重要原因之一。衰老程度可通过外观、血液生化指标、脏器相关指标、行为学及分子生物学等多方面进行检测。如反映抗氧化能力的血清超氧化物歧化酶(SOD)活力、谷胱甘肽过氧化物酶(GSH-PX)活力,丙二醛含量等。SOD是机体内重要抗氧化酶之一,其活力和含量反映了机体清除氧自由基的能力。丙二醛能引起突变使细胞结构和功能被破坏,以此反映体内自由基产生和老化程度。血管内皮生长因子(VEGF)促进新生血管形成、抑制丙二醛生成并增强SOD活性而对抗衰老。所有这些因子的改变均由于其特定的功能细胞老化、功能下降,及没有足够的干细胞对其进行及时更新所致。
干细胞 是具有自我复制和多向分化潜能的细胞,能产生表现型和基因型与自己完全相同的子代干细胞,又能在一定条件下分化为各种功能细胞。干细胞医疗技术被《科学》、《自然》等杂志评为21世纪生物科学领域最具发展前景的技术,是攻克各种传统医学力所不及的重大疾病的一种崭新的医疗技术。2007年英国科学家Anastasia在自然杂志撰文指出成体干细胞对人体自我修复和组织再生至关重要,成体干细胞减少是人体衰老的主要原因。
干细胞的伦理问题主要因为胚胎干细胞的问题。当受精卵分裂发育成囊胚时,内层细胞团(Inner Cell Mass)的细胞即为胚胎干细胞。胚胎干细胞具有全能性,可以自我更新并具有分化为体内所有组织的能力。
但是,如果从胚胎中提取干细胞,胚胎就会死亡。因此,美国政府明确反对破坏新的胚胎以获取胚胎干细胞,美国众议院甚至提出全面禁止胚胎干细胞克隆研究的法案。美国的一些科学家则对此提出了尖锐的批评,他们认为,将干细胞用于医学研究,在减轻患者痛苦方面很有潜力。如果浪费这样一个绝好的机会,结果将是悲剧性的。
(3)晚期恶性肿瘤、
(9)非神经系统疾患,或诊断上尚未明确者。
干细胞移植治疗过程:
1、取材:无菌条件下取足月产胎儿脐带(4~5cm);
2、然后提取:无菌条件下去除脐带内的血液、脐带外膜组织及血管组织,提取脐带wharton胶组织;
3、培养:无菌条件下取1mm3脐带wharton胶组织,利用组织块贴壁法和双酶消化法培养;
4、传代、扩增:待细胞融合传代后,将其冲洗、消化后按比例继续培养扩增;
5、分离、纯化:利用贴壁培养筛选法、密度梯度离心法、流式细胞法分离、纯化干细胞;
6、治疗:干细胞培养成功后通过静脉滴注、腰穿、动脉介入等方法植入患者体内。
干细胞移植治疗的优势:
1、经过数千例的临床证实,在尚未完全了解疾病的确切机理前也可以应用。
2、相比传统治疗的治标不治本,干细胞通过对受损细胞的修复、替代和重建,从而使疾病得到根本上的治疗。
3、治疗范围广阔,包括神经系统疾病、自身免疫疾病等疾病,是众多“不治之症”“疑难杂症”的新希望。
4、经多次毒性、遗传学、局部刺激、发热以及免疫毒性试验,结果研究表明,干细胞是最安全、无毒无副作用。
5、一个疗程下来,患者的症状就会得到很明显的改善,疗程短,见效快。
6、干细胞通过静脉输液或者动脉介入,无需开刀,整个过程创伤小、痛苦少。
7、相比传统治疗的副作用对孕妇、婴儿或者老年人伤害大,干细胞治疗更安全,适合各个年龄段患者。
间充质干细胞的出现填补了自体骨髓干细胞在肝脏移植方面的不足。所谓的间充质干细胞就是指具有胚胎干细胞类似的增殖能力和多向分化潜能,来源丰富,取材方便,无伦理争议,可获取的细胞数量多,细胞活力强,容易扩增和代传,同时又没有配型,排斥等问题,是理想的干细胞来源,以逐渐成为了干细胞治疗的主角。但脐带间充质干细胞的提取和扩增有较高的技术要求,除中国外,只有加拿大,英国,美国等少数几个国家掌握这一技术。在中国只有在福州和北京有同等的干细胞实验室可生产间充质干细胞。
干细胞移植再生术是肝硬化病人的理想选择,中国是肝病大国,仅乙肝病毒携带者就有1.2亿人,在众多的终末期肝病患者中,每年需要肝脏移植者也有数十万。原位肝移植虽已成为终末期肝病最理想的治疗选择,但由于供体肝脏的紧缺、术后不良反应较多、需终身服用免疫抑制剂及高额的医疗费用等限制了其临床应用,在临床治疗中一直以来也没有令人满意的进展。发生急性肝功能衰竭时,短期内出现肝脏功能急剧恶化,导致进行性神志改变、凝血功能障碍、感染、肾功能衰竭等。在肝移植技术推广前,其存活率不足15%,而实行肝移植后,一年存活率接近90%。肝移植虽然是治疗晚期肝衰竭最有效的手段,但由于医学伦理学、移植供体、移植排斥反应、治疗费用等因素的限制,尚难广泛开展。
随着分子生物学和细胞生物工程技术的发展,以及对干细胞研究认识的深入,通过干细胞移植治疗终末期肝病逐渐成为研究的热点,这为终末期肝病,尤其是终末失代偿期肝硬化和急性肝衰竭的治疗提供了一种全新策略。
大量临床及临床前研究表明,干细胞具有定向分化增生的能力,在肝脏环境内能分化为肝细胞,可参与肝脏结构的修复和重构,改善肝功能。进行肝脏干细胞移植在肝脏疾病治疗中可发挥重要作用。
研究表明,肝脏再生需要有干细胞和细胞因子的共同参与。如何控制干细胞的分化发育,让它分化为肝脏细胞呢?专家认为,这取决于移植细胞与生存微环境的联合作用,其中干细胞生存微环境起重要作用。从研究结果来看,只要给予肝脏再生的微环境,干细胞就可以在体内分化为肝细胞。
干细胞的功能强大是医学领域的重大突破 这项世界最新前沿技术是医学领域的重大突破,国内外广泛用于对1型和2型糖尿病、肝硬化、重症肝病、肾病综合征、狼疮性肾炎、股骨头坏死、重症肌无力、男性性功能不全以及周围血管性疾病等300多例常规治疗手段难以治愈的疑难杂症患者进行干细胞临床治疗。
干细胞移植可以治疗脑外伤后遗症患者,是因为干细胞分化后产生的神经元和胶质细胞可以分泌多种神经营养因子,改善脑局部微环境并启动再生相关基因的顺序表达,使损伤轴突开始再生,它们同时产生多种细胞外基质,填充脑损伤后遗留的空腔,为再生的轴突提供支持物;补充外伤后缺失的神经元和胶质细胞;使残存脱髓鞘的神经纤维和新生的神经纤维形成新的髓鞘,保持神经纤维功能的完整性。再辅助系统的康复锻炼。
干细胞移植途径一般采用静脉注射或腰穿的方式,因此该治疗可避免开颅的痛苦,并能减少并发症的发生以及大大缩短患者的住院时间,从而降低了患者的医疗费用。临床表明一些年轻患者在住院期间和出院后半年,情况在持续性变好,主要体现在肌力增加,反映变快,语言表达改善等。
干细胞移植治疗脑瘫,是经后分化的神经元补充缺损的神经元,并促进小儿脑组织中的神经干细胞分化发挥功能,恢复脑神经的正常生长发育,改善大脑认知功能障碍,为脑性瘫痪小儿进一步康复提供了更多的机会,已为现今最有效的治疗方法。并且年龄越小,再构成代偿能力越强,治疗的可能性就越大。如果在神经干细胞移植以后接受规范系统的康复锻炼,将促进所移植神经干细胞的生长和发挥修复作用,效果将会更加理想。
移植途径有静脉注射,腰椎穿刺移植神经干细胞,通过头部立体定向手术的方法,直接将干细胞移植入患者脑内。
国内外传统治疗SCI最常用的方法有手术治疗、药物治疗、康复训练等,但这些方法并不能从根本上解决神经元再生的问题。脊髓损伤治疗的难点:如何使缺损的神经元再生,如何恢复功能性轴突的传导功能。
nerual stemcells,NSCs是20世纪末神经生物学领域最重要的进展之一,因其具备自我更新和多分化潜能的两个基本特性以及迁移功能和良好的组织融合性的优点,而成为细胞移植治疗神经系统疾病良好的移植材料,为脊髓损伤的治疗提供了新的方法。
脊髓损伤后移植的神经干细胞能向损伤处迁移,且存活和增殖,分化为神经元或星形胶质细胞、少突胶质细胞,出现神经细胞轴突与髓鞘的再生,建立正确的和功能性的突触连接;并使残存脱髓鞘的神经纤维和新生的神经纤维形成新的髓鞘,保持神经纤维功能的完整性,恢复受损神经功能;再辅助以系统的康复锻炼。
干细胞治疗脊髓损伤神经干细胞的移植时机:Okano等认为移植选择急性期,大量自由基及兴奋性氨基酸等物质的存在,神经干细胞存活和分化数量少,再通的神经纤维数目少。如果选择恢复期,则可能出现存活的细胞数量较多,但损伤区域胶质瘢痕已经形成导致再通的神经纤维数目少,因此动物实验和临床病历证明移植的最佳时机一般应是损伤后1周~2个月。
干细胞治疗新方法
人脑被称为世界上功能最全、储存量最大、程序最复杂的超级“电脑”,作为神经系统的高级中枢,它主导人体的知觉、运动、思维、记忆,如果脑部“缩水”,脑细胞大量受伤、退化、死亡,也就意味着这些功能的逐渐丧失。过去对于这一超级“电脑”的功能减退,即脑萎缩,是没有任何方法可以治疗的,而如今湖北省中山医院干细胞治疗中心引进的干细胞技术,却可让脑细胞“再生”和“修复”,使得脑萎缩患者有望康复。
疑难病的困扰
据了解,脑萎缩病程数年甚至十数年,可以分为脑动脉硬化性脑萎缩、老年痴呆性脑萎缩、中风后脑萎缩、颈椎病及脑外伤后脑动脉供血不足而导致的脑萎缩等。脑萎缩临床主要表现为注意力不能集中,记忆减退,情绪不稳,行为怪异、走路不稳,手脚震颤,言语含糊、平衡能力差等。一般脑萎缩治疗包括改善脑循环、维生素、神经营养等药物治疗,但收效甚微,难以阻止病情的发展,病情通常逐渐恶化,特别是小脑萎缩,最终发展成进食困难,不能走路,大小便失禁,给患者及家属带来巨大的精神痛苦。
2015年7月15日下午,军事医学科学院附属医院(解放军第307医院)宣布,经过16个月的术后观察,由该院陈虎团队率先开展的世界首例胎盘造血干细胞联合脐带造血干细胞移植治疗重型再生障碍贫血获得成功。
据主治医生扈江伟介绍,2013年12月30日,河北迁安市一位9岁农村女童因患再生障碍性贫血入院治疗。因为患儿病史已经长达5年,且为重型再障,情况严重,如果不采取移植治疗,将因反复出血、感染而导致死亡,结局和白血病患者一样。2014年3月14日,在征得患儿父母同意后,307医院从女童新诞生的妹妹胎盘中提取造血干细胞联合脐带造血干细胞进行移植治疗,患儿康复后出院,造血功能恢复正常,情况稳定。
神经干细胞移植
2002年11月23日,我国第一例神经干细胞移植手术在河南安阳市人民医院获得成功。神经干细胞移植技术是近年来新发展起来的治疗神经系统疾病颇有前景的一项新的科研课题。
神干细胞通过诱导分化,可发育成多种神经细胞,将其移植入神经系统内可以代替损伤的神经细胞,使其执行正常的神经功能。此项技术可用于治疗帕金森氏病,多发性硬化及老年脑血管病等多种神经系统疾病。经查新报告,神经干细胞移植,在欧美国家有用于脑血管病治疗的病例,在国内尚无用于治疗脑血管病的报道。安阳市人民医院神经内科对一名70岁高龄的男性脑血管患者进行了神经干细胞移植术,在国内尚属首例。
病人入院前,右侧偏瘫、失语、不能行走持物、生活不能自理。在神经内科主任杨清成主持,副主任张向东及梁长春、马登飞等医师共同参与下,病人入院实施神经干细胞移植术后,精神状态、肢体肌力明显好转,神经系统体格检查各项评分较前明显提高,已能在家人的搀扶下下床行走。