-
青蒿素 编辑
青蒿素(Artemisinin),是一种有机化合物,分子式为C15H22O5,相对分子质量282.34。青蒿素为无色针状结晶,熔点为156~157℃,易溶于氯仿、丙酮、乙酸乙酯和苯,可溶于乙醇、乙醚,微溶于冷石油醚,几乎不溶于水。因其具有特殊的过氧基团,它对热不稳定,易受湿、热和还原性物质的影响而分解。
青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,尤其是对于脑型疟疾和抗氯喹疟疾,具有速效和低毒的特点,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”。随着研究的深入,青蒿素其它作用也越来越多被发现和应用研究,如抗肿瘤、治疗肺动脉高压、抗糖尿病、胚胎毒性、抗真菌、免疫调节、抗病毒、抗炎、抗肺纤维化、抗菌、心血管作用等多种药理作用。青蒿素是从黄花蒿茎叶中提取,是一种无色针状晶体。青蒿素是非常有效的抗疟疾药物,可以杀灭红细胞内的疟原虫。
药品名称:青蒿素
别名:黄花蒿素、黄花素、黄蒿素
是否处方药:处方药
运动员慎用:慎用
性状:无色针状晶体、味苦
提取物:复合花序植物黄花蒿茎叶
RTECS号:KD4170000
CAS号:63968-64-9
发现者:屠呦呦青蒿素结构研究协作组、青蒿素结构研究协作组
分子式:C15H22O5
主要适用症:疟疾、红斑狼疮
水溶性:几乎不溶
外观:无色针状结晶
剂型:栓剂、片剂
药品类型:化学药品
是否纳入医保:纳入
用法用量:直肠首次0.6g、4小时后0.6g、第2天0.4g
PubChem号:24862236
MDL号:MFCD00081057
熔点:156-157℃(水煎后分解)
分子量:282.33218
主要用药禁忌:孕妇慎用
外文名:Artemisinin、Artemisinine、Qinghaosu
密度:1.3g/cm³
CAS登录号:63968-64-9
研究背景
疟疾是人类最古老的疾病之一,迄今依然还是一个全球广泛关注且亟待解决的重要公共卫生问题。
1631年,意大利传教士萨鲁布里诺(AgostiNOSalumbrino)从南美洲秘鲁人那里获得了一种有效治疗热病的药物——金鸡纳树皮(cinchonabark)并将之带回欧洲用于热病治疗,不久人们发现该药对间歇热具有明显的缓解作用。
1820年,法国化学家佩尔蒂埃(PierreJoseph)和药学家卡文托(JosephBienaiméCaventou)从金鸡纳树皮分离治疗疟疾的有效成分并将之命名为奎宁(quinine)。
1944年,美国有机化学家伍德沃德(RobERTWoodward)与德林(WilliamDoering)第一次成功地人工合成奎宁。此后,科学家们对抗疟药不断改进,形成了以奎宁等为代表的芳、杂环甲醇类,以氯喹等为代表的4-氨基喹啉类,以及以阿莫地喹等为代表的杂环氨酚类抗疟药。这些抗疟药在人类防治疟疾方面起到了重要作用。但随着药物的大量长期使用,疟原虫的耐药性问题逐渐凸显出来。
20世纪60年代初,恶性疟原虫在一些区域已经出现对氯喹的抗药性,尤以东南亚最为严重。当时,随着越南战争的逐步升级,抗氯喹恶性疟的侵袭困扰交战双方,导致作战部队大量减员。为此,美国投入大量的人力、物力来研究疟疾,主要目标是寻找新型的抗疟药物。其中,美国华尔特·里德陆军研究所(WalterReeDArmyInstituteofResearch)从20世纪60年代末开始筛选了20多万种化合物。越南方面受条件所限,无力研制开发新药,于是请求中国帮助解决疟疾防治问题。中方派出研究人员进行了近2年的现场调查以及实地救助,意识到疟疾防治的迫切性与复杂性。
523任务
1964年,越南战争爆发,当时北越军队常出没于山间丛林地区,而这一地区恶性疟疾流行猖獗,且对奎宁及奎诺酮类抗疟药物如氯喹(chloroquine)等普遍具有耐药性,平民与军队的患病人数猛增,越南政府向外界请求支援。
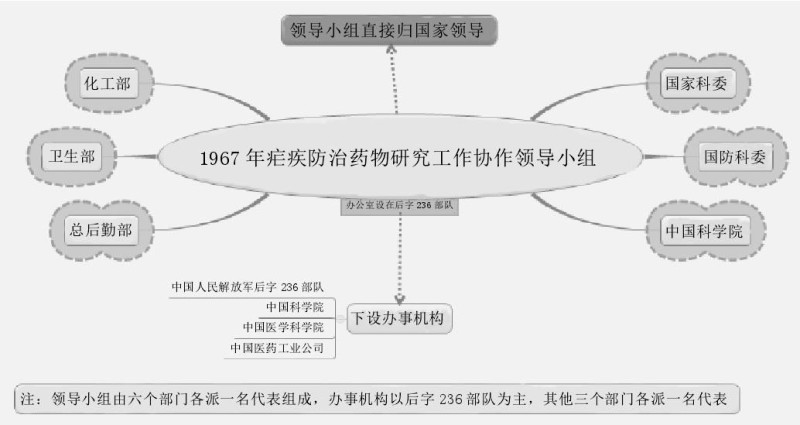
1967年5月23日~5月30日,国家科学技术委员会和中国人民解放军总后勤部于北京召开有关部委、军委总部直属机构和有关省、直辖市、自治区、军区领导及有关单位参加的全国疟疾防治药物研究大协作会议,并提出开展全国疟疾防治药物研究的大协作工作。由于这是一项紧急的军工任务,以开会日期为代号,简称“523任务”。当时国家组织成立全国疟疾防治药物研究领导小组,成员有国家科委、国防科工委、解放军总后勤部、卫生部、化工部、中国科学院等部门。国家科委、解放军总后勤部为正、副组长单位。领导小组下设办事机构,以中国人民解放军后字236部队(军事医学科学院)为主,中国科学院、中国医学科学院、中国医药工业公司各派一名人员。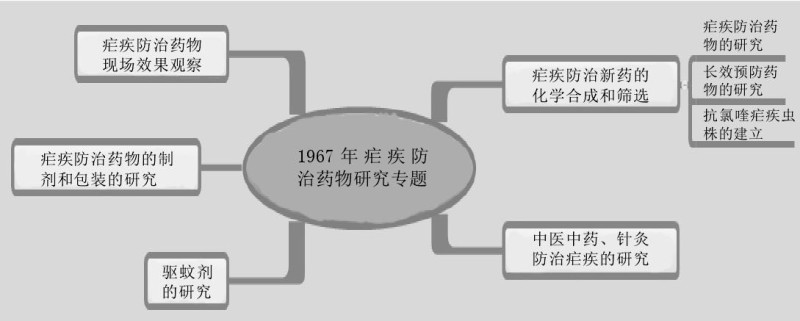
1967年6月,领导小组向参加单位下发《疟疾防治药物研究工作协作规划》,时间为3年;根据专业划分任务,成立化学合成药、中医中药、驱避剂、现场防治4个专业协作组,后来又陆续成立针灸、凶险型疟疾救治、疟疾免疫、灭蚊药械等专项研究的专业协作组。各专业协作组负责落实协作计划、进行学术与技术交流,任务执行时各单位之间的协作则会随着一些外界环境的变化而改变。当时中医中药、针灸防治疟疾研究小组组长单位为中国医学科学院药物研究所;副组长单位为上海针灸研究所和后字236部队,1969年中医研究院中药研究所加入。这个研究小组参与单位有近20家,除发现青蒿素之外,还有许多其他的研究成果,如对常山乙碱的改造、从植物鹰爪和陵水暗罗中分离出有效抗疟单体鹰爪甲素和一种名为暗罗素的金属化合物等。尤其是在对鹰爪甲素进行化学结构研究中,发现其为过氧化物,这为后来研究并合成新抗疟药提供了思路,并且在确定青蒿素的结构过程也起到十分重要的启发作用。
传统药物筛选
“523任务”制定的《中医中药、针灸防治疟疾研究规划方案》第二项为“民间防治疟疾有效药物和疗法的重点调查研究”。该方案的备注中列出了根据文献调查提出的作为重点研究的药物,其中列有青蒿(排在第5位)。但是,在之后的记录中没有发现有关青蒿筛选的相关记载。
1969年,中医研究院中药研究所(简称“北京中药所”)加入“523任务”的“中医中药专业组”。北京中药所于1969年1月接受“523任务”,并指定化学研究室的屠呦呦担任组长,组员是余亚纲和郎林福。4月,中医研究院革委会业务组编成了收集有640余方的《疟疾单秘验方集》。该验方集与当时其他文献类似,都是把与常山相关的验方列在最前面,其中第15页记载有青蒿,但并未对青蒿有特别的关注。
1970年,“全国523办公室”安排军事医学科学院的顾国明到北京中药所协助他们从传统中药中寻找抗疟药物。余亚纲查阅中医药文献,并且以1965年上海市中医文献馆出版的《疟疾专辑》为蓝本,进行整理分析后列出重点筛选的药物为:乌头、乌梅、鳖甲、青蒿等。他们共用水煎或乙醇提取,筛选了近百个药方,北京中药所档案显示,从1970年2月开始,屠呦呦小组一共送了10批166种样品到军事医学科学院进行检测,其中第8批中最后一个药物为雄黄,抑制率为100%;第9批中也出现了几次雄黄,抑制率均在90%以上;青蒿出现第10批样品中,抑制率显示为68%,其提取溶剂为乙醇。
青蒿素的发现
1971年5月21日~6月1日全国疟疾防治研究工作座谈会在广州召开,会后,北京中药所重新组织了研究小组,屠呦呦仍任组长,与组员钟裕蓉继续提取中药,郎林福和刘菊福做动物试验。根据北京中药所的药物筛选记录,1971年7月26日筛选(序号16)青蒿抑制率12%,9月1日(序号114)青蒿醇抑制率40%,10月4日(序号191)青蒿乙醚抑制率达100%。1971年1月起,屠呦呦小组开始大量提取青蒿乙醚提取物,并于当年6月底完成了狗的毒性试验。为了能尽快开展临床试验,在当年对青蒿乙醚提取物对狗的毒性试验结果尚存在一定争议的同时,6~8月期间,屠呦呦、郎林福、岳凤仙与章国镇、严述常、潘恒杰、赵爱华、方文贤先后以不同剂量分作两批进行了青蒿乙醚中性提取部分的自体试服,均未出现明显的毒副作用。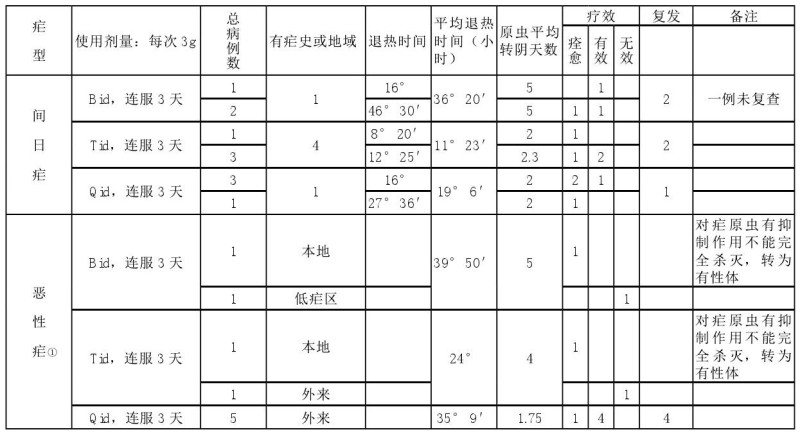
1972年3月8日,屠呦呦作为北京中药所的代表,在“全国523办公室”主持的南京“中医中药专业组”会议上作题为《用毛泽东思想指导发掘抗疟中草药工作》的报告,报告了青蒿乙醚中性粗提物的鼠疟、猴疟抑制率达100%的结果,引起全体与会者的关注。资料显示,复筛时屠呦呦从本草和民间的“绞汁”服用的说法中得到启发,考虑到有效成分可能在亲脂部分,于是改用乙醚提取,这样动物效价才有了显著提高,使青蒿的动物效价由30%~40%提高到95%以上。
1972年8月,屠呦呦带队在海南岛开展青蒿乙醚中性提取物的临床疗效试验。期间,倪慕云设计了色谱柱分离的前处理,使青蒿乙醚提取物中性部分的抗疟作用再次得到提高。钟裕蓉从文献获知硅胶柱分离中性化合物更有效,于是便与助手崔淑莲在倪慕云柱前处理的基础上,按文献提供的方法用硅胶柱层析,石油醚-乙醚(后改为石油醚-乙酸乙酯)梯度洗脱,分离乙醚中性提取物。
1972年11月8日,改用上海试剂厂生产的硅胶柱分离,然后用石油醚和乙酸乙酯-石油醚(不同比例)多次洗脱。最先获得少量的针状结晶,编号为“针晶Ⅰ”(No.1或针1);随后洗脱出来的针状结晶编号为“针晶Ⅱ”(No.2或针2);再后来得到的另一种方形结晶,编号为“结晶Ⅲ”(No.3或方晶)。同年12月初,经鼠疟试验证明,“针晶Ⅱ”是唯一具备抗疟作用的有效单体。此后,北京中药所向“全国523办公室”汇报时,将抗疟有效成分“针晶Ⅱ”改称为“青蒿素Ⅱ”,有时也称青蒿素。再后,北京中药所均称“青蒿素Ⅱ”为青蒿素。
其他药物发现
1972年10月21日山东省寄生虫病研究所研究人员在用乙醚及酒精对山东产的黄蒿进行提取,经动物试验,获得较好的效果后,向“全国523办公室”作了书面报告并指出:黄花蒿的提取物抗鼠疟的结果,与北京中药所青蒿提取物的实验报告一致。当年11月,山东省中医药研究所从山东省泰安地区采来的黄花蒿(ArtemisiaannuaL.)中分离提取出7种结晶,其中第5号结晶命名为“黄花蒿素”,具有抗疟作用。1972年底,云南“523办公室”副主任傅良书得知了北京中药所青蒿研究的情况后,提出利用当地植物资源丰富的有利条件,对菊科蒿属植物进行普筛。
1973年春节期间,罗泽渊在云南大学校园内发现了一种一尺多高、气味很浓的艾属植物——“苦蒿”,当下采了样本,带回所里晒干后进行提取。结果发现“苦蒿”的乙醚提取物有抗疟效果,复筛后结果一样。他们边筛选边提取,当年4月,罗泽渊分离得到抗疟有效单体“苦蒿结晶Ⅲ”,后改称为“黄蒿素”。
结构测定
1973年初,北京中药所开始着手对青蒿素Ⅱ进行结构测定,但由于化学研究力量和仪器设备薄弱,结果不理想。
自1974年2月到1976年间,北京中药所先后派出倪慕云、钟裕蓉、樊菊芬和刘静明到中国科学院上海有机化学研究所(简称“有机所”)参与结构测定工作。
1975年,屠呦呦与中国科学院生物物理研究所(简称“生物物理所”)取得联系并开展协作,用当时国内先进的X衍射方法测定青蒿素的化学结构。在1975年底至1976年初得到了青蒿素的晶体结构;后经梁丽等在精细地测定反射强度数据的基础上,确立了青蒿素的绝对构型。
临床验证
1973年9月,北京中药所研究人员带上所里分离获得的青蒿素Ⅱ100多克赴海南开展临床验证,一共做了8例临床,其中恶性疟5例、间日疟3例。结果显示,青蒿素对间日疟有效,但是未能证明对恶性疟的效果。
1974年5月中上旬,山东省黄花蒿协作组在山东巨野县城关东公社朱庄大队用黄花蒿素对10例间日疟患者进行临床观察,效果很好。9月8日,云南临床协作组的陆伟东、王学忠带着黄蒿素到云县、茶坊一带进行临床效果观察。并且提供药给广东中医学院的李国桥率医疗队开展的脑型疟的救治以及“7351”的临床验证等工作。到当年年底,广东医疗队共验证了18例,其中恶性疟14例(包括孕妇脑型疟1例、黄疸型疟疾2例)、间日疟4例。汇集之前云南协作组验证的3例患者,云南提取的黄蒿素首次共验证了21例病人,其中间日疟6例、恶性疟15例,全部有效。此次试验明确了黄蒿素对恶性疟疾的效果。
1975年4月,在成都召开了“523任务”中医中药专业座谈会。由于李国桥等用黄蒿素治疗恶性疟取得了良好效果,制定了当年的研究计划,开始进行全国范围内的临床验证。
截至1978年11月青蒿素(包括黄花蒿素、黄蒿素)治疗疟疾科研成果鉴定会时,参与青蒿及青蒿素研究和协作的单位有45家之多。这些单位用青蒿粗制剂、青蒿素共进行了6555例的临床验证,用青蒿素制剂治疗的有2099例,其中恶性疟588例(含脑型疟141例)、间日疟1511例。
青蒿素改造
青蒿素对疟疾具有速效、低毒的特点,但是用后其“复燃率”很高,而且只能口服,生物利用度低,且因溶解度小而难以制成注射剂液用于抢救严重病人。
1976年2月,“全国523办公室”将青蒿素结构改造的任务下达给中国科学院上海药物研究所(简称“上海药物所”)。上海药物所发现双氢青蒿素的效价比青蒿素高1倍。由于双氢青蒿素的分子中存在半缩醛的结构,性质不够稳定,而且溶解度也未见改善,李英等又从双氢青蒿素出发合成了它的醚类、羧酸酯类和碳酸酯类衍生物。顾浩明等通过动物试验,发现几十个衍生物的抗疟活性几乎都高于青蒿素;其中,SM224(后命名为“蒿甲醚”)的油溶性大、性质稳定,抗疟活性是青蒿素的6倍,因而被选中为重点研究对象。
1977年8月,桂林制药厂刘旭等设计合成了10多个青蒿素衍生物;其中双氢青蒿素的琥珀酸半酯在鼠疟筛选中抗疟效价比青蒿素高3~7倍,可生成溶于水的钠盐,用于制备水溶性静脉注射剂,是救治重症疟疾的速效、方便使用的剂型。
1978年7~9月,在完成药学、药理、药代、药效、毒理、制剂等实验研究后,领导小组批准蒿甲醚在海南岛进行首次临床试验,临床试验证明疗效很好。
20世纪80年代初,青蒿素类单药(青蒿素、蒿甲醚、青蒿琥酯)问世不久,仍在临床试验阶段,对恶性疟表现出高效、速效和低毒的治疗效果,但3~5天疗程杀虫不彻底,易复燃,在长期广泛使用单药时可能会使疟原虫较快产生抗性。
1990年,北京中药所邀请中国医学科学院药物研究所、军事医学科学院微生物流行病研究所等单位讨论,认为双氢青蒿素是蒿甲醚和青蒿琥酯的体内活性代谢产物,而且生产成本较低,可以作为开发对象。于是启动了对双氢青蒿素的抗疟药理、毒理和安全性的评价,后由广州中医学院进行临床试验,先后在海南岛收治恶性疟患者349例。其中,7天疗程总剂量480毫克治疗了239例,观察28天后,发现治愈率达97.5%,结果表明双氢青蒿素具有良好的抗疟效果。
青蒿素组方
1982年下半年,军事医学科学院周义清和滕翕和向中国青蒿素及其衍生物研究指导委员会提出“合并用药延缓青蒿素抗性产生的探索研究”立题申请,得到批准,并提供启动经费。邓蓉仙、滕翕和组织自主研发的本芴醇(也是“523任务”期间的成果之一)与青蒿素组方既显示出速效的特点,又有治愈率高的优点。最后经过鼠疟、猴疟的各种实验之后发现蒿甲醚和本芴醇1:6配比适宜,并于1992年完成了全部研究工作。
为了进一步提高疗效,缩短疗程,延缓抗药性的产生,中国科学家用青蒿素及其衍生物与“523任务”期间或之后化学组研究人员研发的新化学抗疟药配伍,不仅发明了蒿甲醚本芴醇复方(coartem),还有双氢青蒿素磷酸哌喹复方(artekin)、青蒿素磷酸萘酚喹复方(arco)、复方哌喹片(CV8)、青蒿素-哌喹片(artequick)等。
青蒿素类抗疟药组成复方或联合用药(ACTs),已被世界卫生组织(WHO)确定为全球治疗疟疾必须使用的唯一用药方法。利用青蒿素类药复方加服小剂量的伯喹治疗现症病人以阻止疟疾传播的技术,也被WHO确认和推荐。
1986年,青蒿素和双氢青蒿素获一类新药证书,1992年获得“全国十大科技成就奖”,1997年获得“新中国十大卫生成就”之一称号。
2011年9月,屠呦呦因青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖风向标的拉斯克奖。
2015年10月,屠呦呦因创制新型抗疟药—青蒿素和双氢青蒿素的贡献,“or her discoveries conceRNIng a novel therapy against Malaria”,与另外两位科学家获2015年度诺贝尔生理学或医学奖。
2016年,科学杂志《eLife》刊登,德国马克斯普朗克分子植物生理学研究所专家发明了利用COSTREL方法从烟草中大量提取青蒿素的方法。
2019年6月17日,新华社电,经过三年多科研攻坚,屠呦呦团队在“抗疟机理研究”“抗药性成因”“调整治疗手段”等方面终获新突破,提出新的治疗应对方案:一是适当延长用药时间,由三天疗法增至五天或七天疗法;二是更换青蒿素联合疗法中已产生抗药性的辅助药物。国际顶级医学期刊《新英格兰医学杂志(NEJM)》刊载了屠呦呦团队该项重大研究成果和“青蒿素抗药性”治疗应对方案。
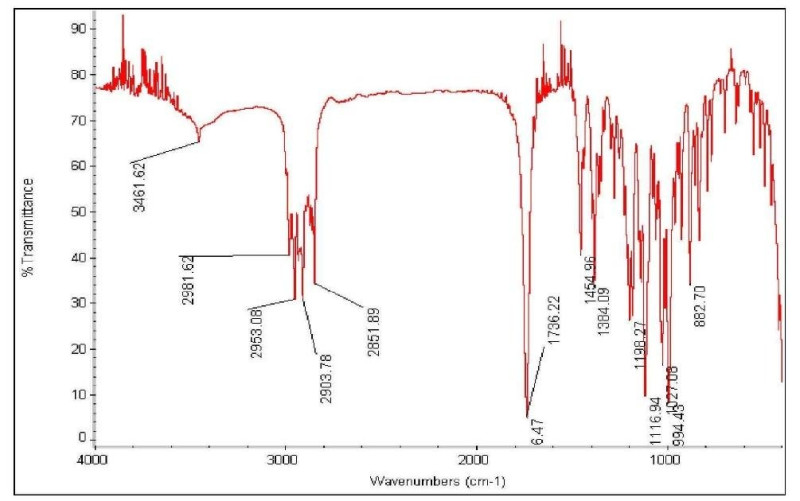
青蒿素为无色针状结晶,熔点为156~157℃,(C=1.64氯仿)。易溶于氯仿、丙酮、乙酸乙酯和苯,可溶于乙醇、乙醚,微溶于冷石油醚,几乎不溶于水。因其具有特殊的过氧基团,它对热不稳定,易受湿、热和还原性物质的影响而分解。
IR谱(KBr)具有一个六元环内酯(1745cm)和过氧基团(831,881,1115cm-1)。不含双键,无紫外吸收。高分辨质谱(m/e282.1472M+)及元素分析(C63.72%,7.86%)。
结晶学参数:空间群,晶胞参数a=24.098Å,b=9.468Å,c=6.399Å。
密度:实验d0=1.30g/cm3,计算d0=1.294g/cm3,单胞中分子数Z=4。
化学性质
过氧基团反应
青蒿素与三苯基磷反应可以证明青蒿素含有一个当量的过氧基,其做法是青蒿素在三苯基磷和二甲苯溶液中通氮气回流,再加甲醛及水搅拌,水洗有机层,合并水层及酸性溶液,加碱后,用无过氧化物乙醚提取,无水硫酸钠干燥,除去乙醚,测得三苯基磷重量,结果证明消耗三苯基磷克分子数与青蒿素相近。显色反应
显色反应是用以鉴定青蒿素简单可行的方法,报道较多,主要有以下几种:
(1)对二甲氨基苯甲醛缩合反应:取实验产品青蒿素约10mg,加乙醇2mL溶解,加对二甲氨基苯甲醛试剂1mL置水浴上加热,溶液呈蓝紫色反应。
(2)异羟肟酸铁反应:取样同(1),溶于1mL甲醇中,加入φ=7%盐酸羟胺甲醇溶液4~5滴,在水浴上加热至沸,冷却后加稀盐酸调至酸性,再加入φ=1%FeCl3,乙醇溶液1~2滴,溶液呈紫红色反应。
(3)2,4-二硝基苯肼反应:取样同(1),溶于1mL氯仿后,滴于滤纸片上,以2,4-二硝基肼试液喷洒,在80℃烘箱中烘10min,产生黄色斑点。
(4)碱性间二硝基苯反应:取样同(1),溶于2mL乙醇中,加入φ=2%间二硝基苯的乙醇液和饱和的KOH乙醇液各数滴,水浴微热,溶液呈红色反应。
氢解反应
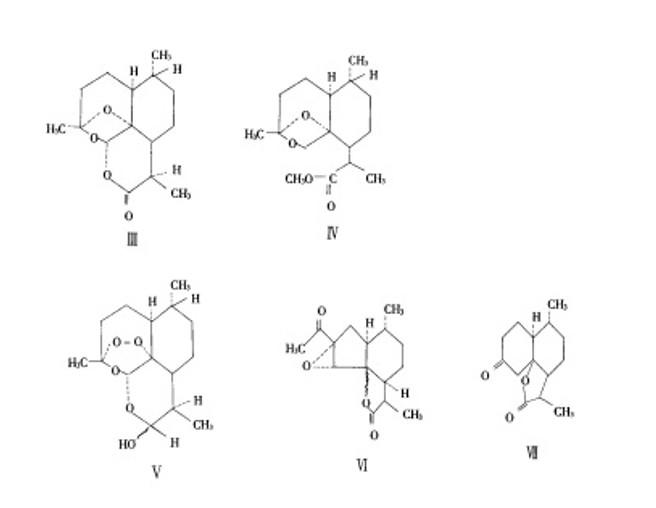
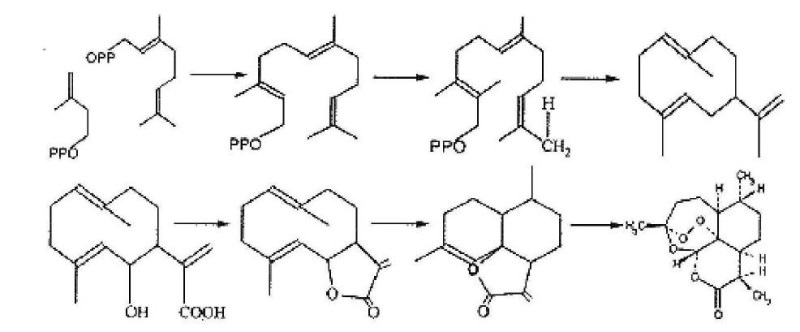
青蒿素在含有钯-碳酸钙的甲醇溶液中,在常温、常压下催化氢化,过氧化物被还原成化合物Ⅲ(图1中的Ⅲ)。在此反应过程中,反应最初所得为油状物,若将其溶于有少量丙酮的正己烷中,需放置4~5d,变为化合物Ⅲ的晶体,而在重氮甲烷中则甲酯化得到甲酯化合物Ⅳ(图1中的Ⅳ)。
还原反应
青蒿素溶于甲醇,在冰浴中(0~5℃)搅拌分次慢慢加入固体硼氢化钠,加完后继续搅拌半小时。反应液用冰醋酸中和,减压除去溶媒,即得到化合物Ⅴ(图1中的Ⅴ)的粗结晶产物,它是用硼氢化钠还原青蒿素而得到的半缩醛化合物。如用钯-碳酸钙在常温常压下进行催化氢化,则会失去氧而得到环氧化合物。
与碱反应
青蒿素加甲醇溶解,另取碳酸钾溶于水,将此碳酸钾溶液在搅拌下缓缓加入青蒿素甲醇溶液,使成均匀混和成澄清液,在20~22℃恒温1h,加入水,用乙醚提取两次,醚层用少量水洗2次,水层用φ=10%盐酸酸化至pH=2,再用乙醚提取3次。乙醚层用水洗至中性,经无水硫酸钠干燥2~3h,乙醚层减压抽干,所得残余物放冰箱过液,有半固体析出,加少许甲醇,冷却,析出针状结晶,即为化合物Ⅵ(图1中的Ⅵ),过滤再结晶一次,则得到更精制的结晶。
与酸反应
青蒿素加入到冰醋酸-浓H2SO4混合液中摇匀,使溶解,25℃放置16~17h,溶液呈浅棕黄色微带荧光,将反应液倒入等体积冰水中,搅匀,用氯仿提取3次,氯仿层用水冲洗至中性,无水硫酸钠干燥,减压除去有机溶剂,得粗结晶,重结晶2次,即得化合物Ⅶ(图1中的Ⅶ)的片状结晶,熔点144~146℃,(C=.2.1氯仿)。
化学合成
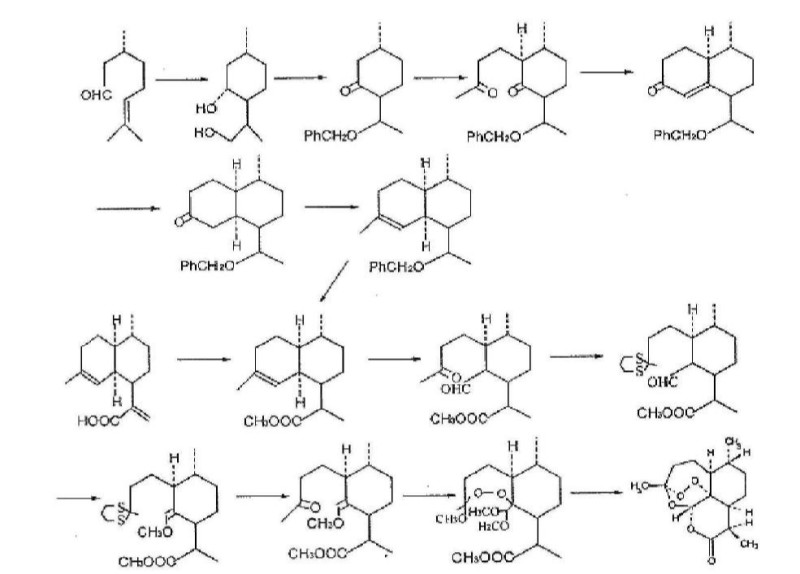
通过化学途径合成青蒿素的难度极大。1983年,化学家HofheinZW等通过化学研究发现了青蒿素的化学合成方法,以(-)-2-异薄勒醇为原料,利用光氧化反应引进氧基得到中间体,再经过环合反应合成了最终产物。合成倍半萜内酯,主要有两个限速步骤:倍半萜母核的折叠和环化;含过氧桥的倍半萜内酯的形成程。
1986年,中国科学家周维善以R-(+)-香茅醛为原料合成了青蒿素。但由于合成步骤繁琐,总收率较低,甚至不到1%,尚未实现工业化的可行性测评。
生物合成
萜类化合物的生物合成途径非常复杂,对于青蒿素这一类低含量的复杂分子的生物合成研究更是如此。用以下三种途径可生物合成青蒿素:通过添加生物合成的前体来增加青蒿素的含量;通过对控制青蒿素合成的关键酶进行调控,或者对关键酶控制的基因进行激活来大幅度增加青蒿素的含量;利用基因工程手段来改变关键基因以增强它们所控制酶的效率。
对于倍半萜内酯的合成,其限速步骤一是环化和折叠成倍半萜母核的过程,另一个限速步骤为形成含过氧桥的倍半萜内酯过程。研究人员通过放射性元素示踪法对青蒿素的生物合成途径进行了研究,认为青蒿素的生物合成可以从法尼基焦磷酸出发,经耗牛儿间架(germacrane)、双氢木香交酯(dihydrocostunodile)、杜松烯内酯(cardinanolide)和青蔷素B(arteannuin B),最终合成青蒿素。当然除青蒿外,其他植物并非不可行。2011年研究人员从烟草中合成青蒿素。此方法与传统化学方法相比,所用的化学试剂大大减少,有利于环境的保护,且该生物合成方法的受体为烟草,在中国较为广泛,因此原料来源较为丰富,但不足的是用烟草合成青蒿素过程中的某些反应基质并不清楚,还有待开发,但该合成方法仍有较好的工业应用前景。
将一个青蒿基因植入大肠杆菌,改造后的大肠杆菌制造出一种中间化合物,这种化合物经过数步处理就能成为青蒿素的原料——青蒿酸。把一种特殊的酶植入酵母后,酵母把前面提到的中间化合物改造成了青蒿酸。通过微生物工业生产青蒿素的技术链条已经基本成形。这意味着青蒿素的价格将下降90%。
提取纯化
商用的青蒿素主要来自于植物提取物,理论上植物中青蒿素含量达以上的青篙才有提取青蒿素的价值。而天然植物中青蒿素的含量受地理环境、采集时间、采集部位、气温和施肥等因素的影响。中国北方产的黄花蒿中青蒿素含量极低。20世纪60-70年代就有单位进行过中药青蒿的分离研究,但未有所获,后来推测可能和产地分布有关。即使在能够提取青蒿素的地区,不同产地青蒿素的含量差异也很显著,最高可达干重的1~2%。有人认为青篙的采集期在生长盛期至花蕾期之前较好,一天中采集时间以晴天中午12~16时为宜。而在青篙植物的上部和枝条上部的叶片中,青篙素含量最高,嫩叶比老叶的含量高。不同干燥方法也有一定的影响,自然晒干的效果比阴干的样品含量高。
从青蒿中提取青蒿素的方法是以萃取原理为基础,主要有乙醚浸提法和溶剂汽油浸提法。挥发油主要采用水蒸汽蒸馏提取,减压蒸馏分离,其工艺为:投料---加水---蒸馏---冷却---油水分离---精油;非挥发性成分主要采用有机溶剂提取,柱层析及重结晶分离,基本工艺为:干燥---破碎---浸泡、萃取(反复进行)---浓缩提取液---粗品---精制。
相对具体方法比如,丙酮一硅胶柱层析法,将植物青篙的叶子和花蕾用丙酮浸泡二次,每次一小时,合并滤出液,常压回收丙酮至小体积,然后加入乙醇于小体积的丙酮提取液中进行脱蜡,在50℃以下搅拌混匀,使其基本溶解后,在10℃以下放置12小时,用纱布过滤。所得乙醇滤液进行层析分离,可得青蒿素。或用低沸汽油-超短粗型球状扩孔硅胶过滤层吸法,采用低沸点汽油为溶剂,反复热回流浸提青蒿干碎叶,热回流时间至少10小时,反复至少4次,将提取液通过装有球形扩孔硅胶的超短粗柱,进行选择性过滤。采用异丙醇或醋酸乙酷同低沸点汽油的混合液为洗脱液通过柱体进行洗脱,然后浓缩流出液,即得青蒿素粗品。
也可采取超临界法提取,比如在提取压力8~32MPa,提取温度30~70℃,解析压力4~8MPa,解析温度30~70℃下通过循环分离青蒿素,提取时间0.5~5小时,提取率可达92%。
青蒿素的提取方法虽多,但弊端同样不少。汽油法简练,工艺流程短,操作方便,但此法大量消耗汽油,安全性存在问题,且由于沸点高,母液处理困难,需减压回收,回收率低。乙醇法溶剂回收温度较难控制,有效成份易受破坏,收率低。硅胶层析法用硅胶做吸附剂,一次性使用,用量大,成本高,装柱困难,而且分离时间长,分离效果差,溶剂用量大。超临界法速度快,效率高,但投资高。
利用植物组织培养来生产青篙素是青篙素研究的另一热点,可能成为大规模生产青篙素的重要手段。自80年代以来,植物组织培养生产青篙素的研究工作已进行不少,已经在青篙愈伤组织、悬浮细胞、芽和毛状根等培养体系中进行了青篙素合成的探索。
化学分析法中的碘量法是利用氧化还原性质对青蒿素进行定量分析的经典方法。而改进的桥式有机过氧物碘量法以2.5mol·L-1硫酸-无水乙醇为酸性介质,减少碘的自身氧化,提高了此法的准确性。但该法操作相对繁杂,已少用。生物化学法以其专一性强、灵敏度高的优点受到关注,而使用特异性强的酶联免疫法(ELISA法)、放射免疫分析法(RIA法)等定量分析青蒿素时通常会遇到成本高、操作复杂等问题,不具有普遍性。应用较多的是紫外光谱分析法和高效液相色谱法。
光谱分析法
青蒿素仅在紫外区203nm处有极弱的末端吸收,不能直接采用紫外分光光度法(UV法)检测。因此需要将青蒿素通过碱或酸溶液进行衍生后才能产生具有紫外吸收的化合物(α、β-不饱和酮酸盐),在波长292nm或260nm处进行紫外检测。UV、高效液相色谱紫外检测法(HPLC-UV)都是基于以上原理。这类方法操作步骤烦琐、费时,经过碱、酸衍生化处理后青蒿素结构易受到破坏,产生含量损失。青蒿素类似物也易参与衍生,产生多个杂峰,使检测准确性受到影响。青蒿素无荧光生色团,在测定人体血液或尿液中含量时需与其他物质作用间接通过荧光光谱分析法(XRF法)得到结果。虽然灵敏度有所提高,但过程相对复杂。
色谱分析法
1、薄层色谱法和气相色谱法
薄层色谱法(TLC)是快速分离和定性分析少量物质的一种很重要的实验技术。中国药典2010年版以石油醚(60~90℃)-乙醚(4:5)为展开剂,2%香草醛的10%硫酸乙醇溶液为显色剂,并规定该法为青蒿素的鉴别方法。薄层色谱扫描法(TLCS)应用于青蒿素的定量分析具有灵敏度及分辨率高的优点,但重现性、可比性欠佳。
气相色谱法(GC)不宜直接用于青蒿素的定量分析,这是由于青蒿素具有热不稳定性,170℃以上就会开始分解。因而,只有通过寻找分解产物与青蒿素之间的线性关系来间接实现定量。
2、蒸发光散射检测法
蒸发光散射检测法是将色谱仪与蒸发光散射检测器(ELSD)联用的一种新型色谱技术。恒定流速的色谱仪洗脱液进入ELSD后被高压气流雾化,形成小液滴进入蒸发室。流动相及低沸点组分被蒸发而剩下的高沸点组分小液滴进入散射池。光束穿过散射池时被散射,光电管接收散射光最终通过计算机得到有效的色谱图。基于以上测试原理,该检测器具有响应值不依赖于样品光学性质的特点,对热不稳定和挥发性化合物亦有较高灵敏度。尤其是对无紫外或紫外末端吸收的大分子有机化合物的检测显示出极大的优越性,准确度优于UV检测。国内外均有研究者将该技术应用于青蒿素分析测定。
惠玉虎等建立HPLC-ELSD测定黄花蒿提取物中青蒿素的方法,以乙腈-水(69:31)为流动相,检测器温度为45℃。发现青蒿素在0.5893~5.8935mg·mL-1时面积对数值与其浓度对数值有良好的线性关系(r=0.989),样品平均回收率为98.71%。
Peng等用HPLC-ELSD和GC方法对青蒿素及青蒿酸进行了定量分析,2种方法检测限分别为50ng·mL-1和30ng·mL-1。实验发现HPLC-ELSD的检测是基于青蒿素的整个分子结构,与LC联合使用更有利于提高ELSD的灵敏度。而GC主要是依靠青蒿素的分解产物,适用于青蒿酸的检测分析。
张东等用HPLC-ELSD测定青蒿素片中青蒿素的含量,成功得克服了辅料对青蒿素测定的干扰。通过建立标准曲线发现青蒿素在1.002~4.008μg·mL-1内呈现良好的线性关系,实现了微量青蒿素的测量。该法比采用反相HPLC法的定量下限降低了1个数量级,客观反映了青蒿素的含量。
TeresaCARBonara等利用HPLC-ELSD建立了青蒿素及咖啡酸、绿原酸、3,4-二咖啡酰奎宁酸的标准曲线,并测定了青蒿叶不同提取时间水提物中青蒿素的含量。HPLC-ELSD用于青蒿素的定量分析简化了操作步骤,提高了实验效率。具有准确度高、专属性强、结果准确等优点。
3、超临界流体色谱法
超临界流体色谱(SFC)技术是一种以固体吸附剂(如硅胶)或键合到载体(或毛细管壁)上的高聚物为固定相,以超临界流体为流动相的色谱法。SFC通过控制压力调节流动相的密度实现对被分离物质溶解度的调节,使不同物质分离。超临界流体的溶解能力强,流动性好,传质速率快,使该法具有分析速度快、选择性好、分离效率高、分析条件温和等优点。SFC可以与GC和HPLC所用的检测器联用,SFC用于青蒿素的分析有快速、专一性强的特点。
Marcel等采用CO2-SFE技术从黄花蒿中提取青蒿素,压力15.15MPa、温度50℃,并用3%甲醇做夹带剂,在20min内完成了提取过程,紧接着用超临界流体色谱结合火焰离子化检测器(SFC-FID)进行定量分析。此连续过程不需要对萃取物进一步纯化和前处理,并排除了色素的干扰,节省了大量的时间与精力,产量高于固相萃取法。
Mount等用电子捕获-超临界流体色谱(SFC-ECD)技术测定了血液中青蒿素和蒿乙醚的含量,检测限分别为20ng·mL-1和5ng·mL-1。青蒿素在空气中的稳定性较差,而SFC在青蒿素自然分解温度以下亦具有很好的溶解性,从而保证了检测的准确性。降低SFC流体中氧气和水分的含量是检测限的重要保证。
毛细管电泳法
1、毛细管电泳电导法
当高频电导施加到激励电极上时,电极、毛细管及管内溶液构成了一个电容导通结构,毛细管内溶液的高频电导信号与溶液电导呈线性关系,而溶液电导是溶液离子浓度的函数,故可通过测定高频电流定量组分浓度。使用毛细管电泳电导法测定青蒿素不需要衍生,省去了前处理过程,快速准确。
黄宝美等以Tris-H3BO3为电泳介质,乙醇为有机添加剂,在15kV高压、pH=9.0的条件下,通过建立标准曲线对石油醚中的青蒿素进行了含量分析,检出限为3.2mg·L-1。若使用分光光度法检测双氢青蒿素需加碱或加酸并加热发生开环反应,影响因素较多,灵敏度和特异性较差。
翟海云等采用非接触式电导的毛细管电泳(CE)高频电导法在5min内实现对双氢青蒿素的分离检测,其峰面积与浓度在3.0~165μg·mL-1范围线性关系良好,检出限为1.0μg·mL-1,回收率达98.0%~103%。
2、流动注射-CE
CE与流动注射(FI)联用技术是分析化学的一个新的发展方向,它将样品的自动化注入、在线转化衍生和分离测定等过程有机地集成了一个简便、快速的分离测定体系。陈宏丽等用FI-CE测定了石油醚超声提取的青蒿素含量,采用具有加热环的泵将青蒿素和氢氧化钠溶液反应3min后的样品直接注入毛细管中,并用紫外检测器于292nm处进行分析,检测限达5.93μg·mL-1。一次转化反应时间和电泳分离时间约15min,这个FI-CE体系可达到每1小时8次的进样频率。而采用传统的柱前衍生HPLC方法完成1次分析则需花费1h。
Cheng等将FI-CE体系进一步微缩成芯片大小,将毛细管的有效长度从55cm缩短到了6.5cm,并通过正交试验优化了试验条件,在2min之内完成分析,大大节省了分析时间、提高了进样频率、减少了样品与试剂的消耗,但该方法存在重现性差的缺点。
红外光谱法
红外光是波长在2500~25000nm(波数为4000~400cm-1)的电磁波,有机化合物在此范围由基频、倍频或合频等不同类型的吸收峰产生,其谱带的数目、位置、形状和强度均随化合物及其聚集态的不同而异,这使得红外光谱(IR)法能有效反映出化合物中不同特性基团的结构特征,从而可获取化合物的分子结构特征。因此,人们较多采用IR进行青蒿药材的FT-IR指纹图谱研究。
孙鹏等用FT-IR法对青蒿进行了红外指纹图谱研究,对所建图谱进行了特征峰指认及相关系数对比;并建立了不同产地青蒿药材FT-IR指纹图谱的SAS9.0软件聚类分析和主成分分析方法,对不同产地青蒿药材的鉴别及质量控制提供了科学依据。
CampsC等利用手持式近红外光谱扫描设备对干燥的青蒿叶粉末样品中青蒿素的含量进行测定,以红外图谱中1750cm-1处青蒿素的特征吸收峰作为分析对象进行定量分析。该方法无需样品的前处理,并具有用量少,分析速度快,不破坏样品的特点,但由于红外光的能量不高,所以IR定量的误差较大。
电分析法
电化学分析是一种利用物质的电学和电化学性质来进行检测的一种方法,其灵敏度及准确度都很高,所需设备简单且易于实现自动化的微型化。
杨培慧等研究了青蒿素在不同电极上的电化学行为,发现于20%乙醇的Britton-Rob-inson缓冲溶液(pH=7.2)中,青蒿素在银电极与玻碳电极上分别有一还原峰,并利用还原峰信号,采用二次微分线性扫描伏安法建立了青蒿素定量分析方法,在银电极上检测限达到2.0X10-6mol·L-1。该法可应用于人工合成样品分析,回收率高于UV法,同时避免了前处理对青蒿素的破坏,更方便、快捷。但伏安法测定易受植物组织中杂质干扰,不适于分析植物样品中的成分。
Reys等设计了一种电流传感器,将血红素固定于氧化钛修饰的二氧化硅上,在中性磷酸缓冲介质中对青蒿素浓度进行测定。该方法对电极进行修饰后,有较好的重现性及稳定性,适用于药物的分析检测。
与以往的抗疟药物不同,青蒿素抗疟机理的主要作用是通过对疟原虫表膜线粒体等的功能进行干扰,首先作用于食物泡膜、表膜、线粒体,其次作用于核膜、内质网,对核内染色质也有一定的影响,最终导致虫体结构的全部瓦解,而不是借助于干扰疟原虫的叶酸代谢。其作用机制也可能主要是干扰表膜一线粒体的功能,作用于食物泡膜,阻断营养摄取的最早阶段,使疟原虫较快出现氨基酸饥饿,从而迅速形成自噬泡并不断排出于虫体外,疟原虫最终损失大量细胞质而死亡。具体药理作用分两步:第一步是活化,青蒿素被疟原虫体内的铁催化,其结构中的过氧桥裂解,产生自由基;第二步是烷基化,第一步所产生的自由基与疟原虫蛋白发生络合,形成共价键,使疟原虫蛋白失去功能死亡。
基本信息
本品为(3R,5αS,6R,8αS,9R,12S,12αR)-八氢-3,6,9-三甲基-3,12-氧桥-12H-吡喃并-1,2-苯并二氧杂环庚熳-10(3H)-酮,按干燥品计算,含C15H22O5应为98.0%~102.0%。
性状
本品为无色或白色针状结晶。
本品在丙酮、乙酸乙酯、三氯甲烷中易溶,在甲醇、乙醇、稀乙醇、乙醚及石油醚中溶解,在水中几乎不溶,在冰醋酸中易溶。
熔点
本品的熔点(通则0612第一法)为150~153℃。
比旋度
取本品,精密称定,加无水乙醇溶解并定量稀释制成每1mL中含10mg的溶液,依法测定(通则0621),比旋度为+75°至+78°。
鉴别
1、取本品约5mg,加无水乙醇0.5mL溶解后,加碘化钾试液0.4mL,稀硫酸2.5mL与淀粉指示液4滴,立即显紫色。
2、取本品约5mg,加无水乙醇0.5mL溶解后,加盐酸羟胺试液0.5mL与氢氧化钠试液0.25mL,置水浴中微沸,放冷后,加盐酸2滴和三氯化铁试液1滴,立即显深紫红色。
3、照薄层色谱法(通则0502)试验。
供试品溶液:取本品适量,加二氯甲烷溶解并稀释制成每1mL中约含3mg的溶液。
对照品溶液:取青嵩素对照品适量,加二氯甲烷溶解并稀释制成每1mL中约含3mg的溶液。
色谱条件:采用硅胶G薄层板,以石油醚(60~90℃)-乙醚(1:1)为展开剂。
测定法:吸取上述两种溶液各5µL,分别点于同一薄层板上,展开,晾干,喷以茴香醛甲醇溶液(取冰醋酸10mL与浓硫酸5mL,缓缓加到55mL甲醇中,放冷,将此溶液加入含有0.5mL茴香醛的30mL甲醇中,摇匀,避光保存),在110℃,加热3~5分钟使显色。
结果判断:供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点一致 。
4、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5、本品的红外光吸收图谱应与对照的图谱(光谱集220图) 一致。
以上3或4可选做一项。
检查
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品,加流动相溶解并稀释制成每1mL中约含青蒿素10mg的溶液。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用流动相稀释至刻度,摇匀。
灵敏度溶液:精密量取对照溶液1mL,置20mL量瓶中,用流动相稀释至刻度,摇匀。
色谱条件:用十八烷基硅烷键合硅胶为填充剂(Phenomenex Luna C18柱,4.6mm×150mm,5µm或效能相当的色谱柱),以乙腈-水(50:50)为流动相,检测波长为210nm,进样体积20µL。
系统适用性要求:青嵩素峰与杂质Ⅰ峰(相对保留时间约为0.80)之间的分离度应大于4.0。灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的1.5倍。
限度:供试品溶液的色谱图中如有杂质峰,杂质Ⅰ(相对保留时间约为0.80)校正后的峰面积(校正因子为0.027)不得大于对照溶液主峰面积的0.15倍(0.15%),相对保留时间约为0.10处的杂质峰面积不得大于对照溶液主峰面积的2倍(2.0%),其他单个杂质峰面积不得大于对照溶液主峰面积的0.3倍(0.3%),各杂质峰面积的和(杂质Ⅰ按校正后的峰面积计算)不得大于对照溶液主峰面积的2.5倍(2.5%),小于灵敏度溶液主峰面积的色谱峰忽略不计。
干燥失重
取本品,在80℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣
不得过0.1%(通则0841)。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品约25mg,精密称定,置25mL量瓶中,加流动相溶解并稀释至刻度,摇匀。
对照品溶液
取青嵩素对照品约25mg,精密称定,置25mL量瓶中,加流动相溶解并稀释至刻度,摇匀。
色谱条件与系统适用性要求
除灵敏度要求外,见有关物质项下。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
类别
抗疟药。
贮藏
遮光,密封保存。
以青蒿素类药物为主的联合疗法已经成为世界卫生组织推荐的抗疟疾标准疗法。世卫组织认为,青蒿素联合疗法是当下治疗疟疾最有效的手段,也是抵抗疟疾耐药性效果最好的药物,而中国作为抗疟药物青蒿素的发现方及最大生产方,在全球抗击疟疾进程中发挥了重要作用。尤其在疟疾重灾区非洲,青蒿素已经拯救了上百万生命。根据世卫组织的统计数据,自2000年起,撒哈拉以南非洲地区约2.4亿人口受益于青蒿素联合疗法,约150万人因该疗法避免了疟疾导致的死亡。在西非的贝宁,当地民众都把中国医疗队给他们使用的这种疗效明显、价格便宜的中国药称为“来自遥远东方的神药”。
此外青篙素在其他疾病的治疗中也显示出诱人的前景。如抗血吸虫、调节或抑制体液的免疫功能、提高淋巴细胞的转化率,利胆,祛痰,镇咳,平喘等。已研制出了第二代换代产品和用青篙素治疗肿瘤、黑热病、红斑狼疮等疾病的衍生新药,同时开始探索青篙素治疗艾滋病、恶性肿瘤、利氏曼、血吸虫、涤虫、弓形虫等疾病以及戒毒的新用途。
抗疟疾
青蒿素是继乙氨嘧啶、氯喹、伯喹之后最热门的抗疟特效药,尤其是对于脑型疟疾和抗氯喹疟疾,青蒿素具有速效和低毒的特点。其抗疟疾作用机理主要在于在治疗疟疾的过程通过青蒿素活化产生自由基,自由基与疟原蛋白结合,作用于疟原虫的膜系结构,使其泡膜、核膜以及质膜均遭到破坏,线粒体肿胀,内外膜脱落,从而对疟原虫的细胞结构及其功能造成破坏,且细胞核内的染色质也受到一定的影响。青蒿素还能使疟原虫对异亮氨酸的摄入量明显减少,从而抑制虫体蛋白质的合成。
青蒿素的抗疟疾作用与不同的氧气压力有关,氧气压力越高,青蒿素对于体外培养的恶性疟原虫的半数有效浓度会降低。活性氧不仅可以直接对疟原虫起到破坏的作用,而且会损坏红细胞,从而导致疟原虫死亡。黄花蒿除了对疟原虫有很好的杀灭作用外,对其他寄生虫也有一定的抑制作用。20世纪80年代初,经科研人员初步研究发现,青蒿素具有抗血吸虫的作用,研究证实,在整个服用青蒿素药物阶段对幼虫期的血吸虫都能产生杀灭作用。临床证实,青蒿素及其衍生物在治疗疟疾的过程中,并没有发现特别明显的不良反应。
抗肿瘤
青蒿素的抗肿瘤作用逐渐被人们发现。青蒿素能够致使乳腺癌细胞、肝癌细胞、宫颈癌细胞等多种癌细胞的凋亡,对癌细胞的生长具有显著的抑制作用。青蒿素及其衍生物的抗肿瘤作用主要是依靠诱导细胞的凋亡而实现的。研究发现,青蒿素是通过诱导细胞的凋亡而杀灭肿瘤细胞的。双氢青蒿素可以通过增加活性氧,从而抑制激活缺氧诱导的相关因子,发挥出选择性细胞毒作用。青蒿球酯对人的大肠癌细胞也有一定的抑制作用,研究发现,青蒿琥酯对人的大肠癌细胞的增值抑制作用和凋亡促进作用存在剂量依赖性。线粒体是细胞凋亡的放大器和感受器,调节控制着细胞的代谢活动,线粒体的膜电位诱导细胞的凋亡。青蒿素作用于白血病细胞的细胞膜,改变细胞膜的通透性,使得细胞内的钙离子浓度升高,这样不仅使得钙蛋白酶得以激活,使其膨胀死亡,而且促进了凋亡物质的释放,细胞凋亡加快。
治疗肺动脉高压
肺动脉高压(PAH)是肺动脉重构为特征和以肺动脉压力升高到一定界限的病理生理状态,可以是并发症或综合征。青蒿素用于治疗肺动脉高压:通过舒张血管降低PAH患者的肺动脉压力,改善症状。Zaiman等发现青蒿素具有抗炎作用,青蒿素及其内核物质对多种致炎因子有抑制作用,且还可以抑制炎性介质产生一氧化氮;青蒿素具有免疫调节作用;冯义柏等通过实验研究发现,青蒿素能够抑制血管内皮细胞、血管平滑肌细胞的增殖,进而在PAH的治疗过程中发挥着重要作用;青蒿素能够抑制基质金属蛋白酶的活性,从而抑制肺血管重构;青蒿素可以抑制PAH相关细胞因子的表达,进一步增强青蒿素抗血管重构作用。
免疫调节
研究发现,青蒿素及其衍生物的使用剂量在不会引起细胞毒性的情况下,能够较好的抑制T淋巴细胞丝裂原,从而诱导小鼠脾脏淋巴细胞的增殖。这一发现对于治疗T淋巴细胞所介导的自身免疫性疾病,有很好的参考价值。青蒿玻醋具有增强非特异性免疫的作用,能够使小鼠血清的总补体活性提高。双氢青蒿素对于B淋巴细胞的增殖,能起到直接的抑制作用,从而减少B淋巴细胞对自身抗体的分泌,减轻体液免疫反应,对体液免疫有一定的抑制作用,减少了免疫复合物的形成。
抗真菌
青蒿素的抗真菌作用也使得青蒿素表现出了一定的抗菌活性。研究证实青蒿素的渣粉剂和水煎剂对炭疽杆菌、表皮葡萄球菌、卡他球菌、白喉杆菌均有较强的抑菌作用,对结核杆菌、绿脓杆菌、金黄色葡萄球菌、痢疾杆菌等也具有一定的抑菌作用。
抗糖尿病
2016年12月1日,在线发表于美国CELL(《细胞》)杂志上的一项研究表明,这一药物或许还可以拯救糖尿病患者。来自奥地利科学院CeMM分子医学研究中心等机构的科学家发现,青蒿素能够让产生胰高血糖素的细胞“变身”产生胰岛素的细胞。青蒿素结合了一个称为gephyrin的蛋白。Gephyrin能够激活细胞信号的主要开关——GABA受体。随后,无数的生物化学反应发生变化,导致了胰岛素的产生。另一项研究表明,在小鼠模型中,注射GABA也能导致细胞转化为细胞,表明两种物质靶向了相同的机制。但青蒿素的长期作用需要进一步测试。
其他应用
青蒿素在临床上还具有与冬虫夏草合用,可以抑制狼疮肾炎的复发,以达到保护肾脏的功效。其抗纤维化作用,能够显著降低肺组织的纤维化程度,对于瘢痕的预防和治疗有较好的实用前景。
另外,青蒿素还可以破坏卡氏肺孢子虫膜系结构,引起孢子虫滋养体胞浆及包囊内出现空泡,线粒体肿胀,核膜破裂,内质网肿胀,囊内小体溶解破坏等超微结构的改变,从而抗卡氏肺孢子虫肺炎。青蒿素类药对胚胎有较高的选择性毒性,较低剂量即可使胚胎死亡而导致流产,有可能被开发为人工流产药物。
青蒿素主要是从青蒿中直接提取得到的,或提取青蒿中含量较高的青蒿酸,然后半合成得到的。青蒿虽然在世界各地广泛分布,但青蒿素含量随产地不同差异极大,具有显著的生态显著性。根据研究得知,除了中国部分地区外,世界绝大多数地区生产的青蒿中的青蒿素含量都很低,并无利用价值。
实验类型 | 方式 | 剂量 | |
|---|---|---|---|
大鼠 | LD50 | 口服 | 5576mg/kg(5576mg/kg) |
大鼠 | LD50 | 2571mg/kg(2571mg/kg) | |
小鼠 | LD50 | 口服 | 4228mg/kg(4228mg/kg) |
小鼠 | LD50 | 1558mg/kg(1558mg/kg) | |
小鼠 | LD50 | 肌肉 | 2800mg/kg(2800mg/kg) |
小鼠 | LD | - | >2mg/kg(2000mg/kg) |
狗 | LD | 肌肉 | >800mg/kg(800mg/kg) |
青蒿素及其衍生物都是一种含过氧化基团的倍半萜内酯化合物。将青蒿素结构中的C-10位羧基还原成羟基可以得到双氢青蒿素,而进一步烷氧基化就得到蒿甲醚,而进行酯化就可得到青蒿琥酯。
青蒿琥酯对白血病、大肠癌、黑色素瘤、乳腺癌、卵巢癌、前列腺癌和肾癌细胞均有抑制作用。
双氢青蒿素对胰腺癌、白血病、骨肉瘤和肺癌细胞的抗肿瘤作用甚佳。
蒿淀粉单用或与其他配伍药合用的协同抗肿瘤作用均比青蒿素要强。
10-(4-苯基-1H-1,2,3-三唑)-青蒿素(5a)和紫杉醇处理人结肠癌LS174T细胞系时,能控制获得性耐药途径,恢复紫杉醇的抗癌作用。
蒿甲醚(Artemether)、蒿乙醚(Arteether)等。
①控制疟疾症状(包括间日疟与耐氯喹恶性疟),青蒿素片剂首次1.0g,6~8h后0.5g,第2、3日各0.5g。栓剂首次600mg,4h后600mg,第2、3日各400mg。
②恶性脑型疟,青蒿素水混悬剂,首剂600mg,肌注,第2、3日各肌注150mg。
③系统性红斑狼疮或盘状红斑狼疮,第1个月每次口服0.1g,1日2次,第2个月每次0.1g,每日3次,第3个月每次 0.1g,每日4次。
直肠给药,1次0.4~0.6g,1日0.8~1.2g。
深部肌注,首次200mg,间隔6~8小时后再肌注100mg,第二、三日各肌注100mg,总量500mg;肌注300mg/日,连用3日,总量900mg。小儿15mg/kg,按上述方法3日内注完。
口服,首次服1g,间隔6~8小时后再服0.5g,第二、三日各服0.5g,3日为1疗程。
副作用及不良反应
使用注意事项
2019年8月29日,中国中医科学院青蒿素研究中心在北京大兴奠基。作为全国首个青蒿素研究中心,2021年竣工。
中国青蒿素产业联盟
2016年6月21日,中国青蒿素产业联盟在上海交通大学成立,其目标是要打通青蒿素的产学研链条,将青蒿素从农田种植到成品产出的各个环节有机整合起来。使生产青蒿素的企业能够联合起来,共同进军国际市场。
青蒿素科技联盟
2018年12月20日,青蒿素科技联盟成立大会暨学术研讨会在北京举行。选举产生青蒿素科技联盟第一届理事会,中国中医科学院青蒿素研究中心学术委员会副主任廖福龙研究员、中药研究所党委书记朱晓新研究员当选为联盟第一届理事长。