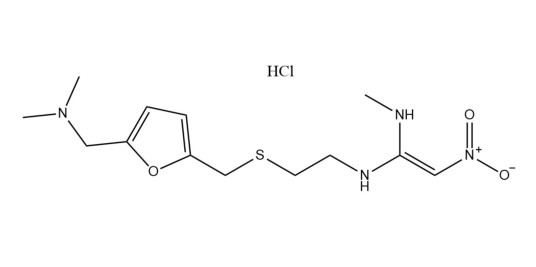
-
盐酸雷尼替丁 编辑
中文名:盐酸雷尼替丁
外文名:Ranitidinehydrochloride
化学式:C13H23ClN4O3S
CAS登录号:66357-59-3
EINECS登录号:266-332-5
熔点:134℃(分解)
外观:灰白色结晶性粉末
安全性描述:S22;S24/25
危险性符号:F;T
危险性描述:R20/21/22
基本信息
化学式:C13H23ClN4O3S
分子量:350.865
CAS号:66357-59-3
EINECS号:266-332-5
理化性质
熔点:134°C(分解)
外观:灰白色结晶性粉末
分子结构数据
摩尔体积(cm3/mol):265.4
等张比容(90.2K):687.5
表面张力(dyne/cm):45.0
极化率(10-24cm3):33.95
计算化学数据
疏水参数计算参考值(XlogP):无
氢键供体数量:3
氢键受体数量:6
可旋转化学键数量:9
拓扑分子极性表面积(TPSA):83.6
重原子数量:22
表面电荷:0
复杂度:347
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:1
不确定化学键立构中心数量:0
共价键单元数量:2
药理作用
为组胺H2受体阻断剂,能抑制基础胃酸分泌及刺激后的胃酸分泌,还可抑制胃蛋白酶的分泌。其抑酸强度比西咪替丁强5~8倍。
适应症
良性胃溃疡,十二指肠溃疡,吻合口溃疡,反流性食管炎,卓-艾氏综合征。
用法用量
1、口服
(1)溃疡病:150mg/次,一日2次,清晨及睡前服。
(2)卓-艾综合征:150mg/次,3次/日,必要时可至900mg/日。8岁以上儿童 75-150mg,一天两次。
2、肌内注射
50mg/次,一日2次。静滴:100~300mg/日,或25mg/小时,每日2次或6~8小时一次。
禁忌
不良反应
可见恶心、皮疹、便秘、乏力、头痛、头晕;偶见静注后出现心动过缓;少见轻度肝功能损伤。长期服用可持续降低胃液酸度,利于胃内细菌繁殖。
注意事项
肝功能不全者及老年患者慎用;严重肾功能不全者剂量应减半;孕妇及婴儿仅限于绝对必要的病例才用,8岁以下儿童禁用。
药物相互作用
来源
本品为N'-甲基-N--2-呋喃基}甲基]硫基]乙基]-2-硝基-1,1-乙烯二胺盐酸盐,按干燥品计算,含C18H22N4O3S·HCl应为97.5%~102.0%。
性状
本品为类白色至淡黄色结晶性粉末,有异臭,极易潮解,吸潮后颜色变深。
鉴别
1、取本品约0.2g,置试管中,用小火缓缓加热,产生的气体能使湿润的醋酸铅试纸显黑色。
2、在含量测定项下记录的图谱中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
3、取本品,加水制成每1mL中含10µg的溶液,照紫外-可见分光光度法(通则0401)测定,在228nm与314nm的波长处有最大吸收。
4、本品的红外光吸收图谱应与对照的图谱(光谱集401图)一致。
可选做2、4和5项或1、2、3和5项。
检查
酸度
取本品0.20g,加水10mL溶解后,依法测定(通则0631),pH值应为4.5~6.5。
溶液的澄清度与颜色
取本品1.0g,加水溶解使成100mL,溶液应澄清无色,如显色,与黄色3号标准比色液(通则0901第一法)比较,不得更深。
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品,加水溶解并稀释制成每1mL中约含1mg的溶液。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用水稀释至刻度,摇匀。
系统适用性溶液:取盐酸雷尼替丁约0.1g,置100mL量瓶中,加50%氢氧化钠溶液1mL,加水约60mL,振摇使溶解,用水稀释至刻度,摇匀,室温放置1小时。
色谱条件:用十八烷基硅烷键合硅胶为填充剂(Kromasil C18,4.6mm×150mm,5µm或效能相当的色谱柱),以磷酸盐缓冲液(取磷酸6.8mL置1900mL水中,加入50%氢氧化钠溶液8.6mL,加水至2000mL,用磷酸或50%氢氧化钠溶液调节pH值至7.1±0.05)-乙腈(98:2)为流动相A,以磷酸盐缓冲液-乙腈(78:22)为流动相B,按下表进行梯度洗脱,流速为每分钟1.5mL,柱温为35°C,检测波长为230nm,进样体积10µL。
时间(分钟) | 流动相A(%) | 流动相B(%) |
0 | 100 | 0 |
15 | 0 | 100 |
23 | 0 | 100 |
24 | 100 | 0 |
30 | 100 | 0 |
系统适用性要求:系统适用性溶液色谱图中,调节流速或流动相比例,使主成分色谱峰的保留时间约为12分钟,杂质Ⅰ的相对保留时间约为0.85,雷尼替丁峰与杂质Ⅰ峰的分离度应大于4.0。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,相对保留时间约为1.75的杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),其他单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.2%),其他各杂质峰面积的和不得大于对照溶液主峰面积的0.5倍(0.5%),小于对照溶液主峰面积0.05倍的色谱峰忽略不计。
干燥失重
取本品,以五氧化二磷为干燥剂,在60℃减压干燥4小时,减失重量不得过0.75%(通则0831)。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品约22mg,精密称定,置200mL量瓶中,加水溶解并稀释至刻度,摇匀。
对照品溶液
取盐酸雷尼替丁对照品约22mg,精密称定,置200mL量瓶中,加水溶解并稀释至刻度,摇匀。
系统适用性溶液、色谱条件与系统适用性要求
见有关物质项下。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
类别
H2受体拮抗药。
贮藏
遮光,密封,在凉暗干燥处保存。
制剂
1、盐酸雷尼替丁片。
2、盐酸雷尼替丁泡腾颗粒。
3、盐酸雷尼替丁注射液。
4、盐酸雷尼替丁胶囊。
安全术语
S22:Do NOt breathe dust.
不要吸入粉尘。
S24/25:Avoid contaCT with skin and eyes.
避免皮肤和眼睛接触。
风险术语
R20/21/22:Harmful by inhalation, in contact with skin and if swallowed.
吸入、与皮肤接触和吞食是有害的。
编号 | 毒性类型 | 测试对象 | 使用剂量 | 毒性作用 | |
|---|---|---|---|---|---|
1 | 急性毒性 | 口服 | 成年女性 | 12 mg/kg/2D-I | 皮肤和附件毒性——皮炎 (全身暴露后) |
2 | 急性毒性 | 口服 | 成年男性 | 8571 μg/kg/2D-I | 肾、输尿管和膀胱毒性——肾小管发生变化 (包括急性肾功能衰竭,急性肾小管坏死) 肾、输尿管和膀胱毒性——间质性肾炎 |
3 | 急性毒性 | 口服 | 儿童 | 2400 mg/kg/43W-I | 行为毒性——昏迷 皮肤和附件毒性——出汗 |
4 | 急性毒性 | 口服 | 成年女性 | 3 mg/kg | 皮肤和附件毒性——皮炎 (全身暴露后) |
5 | 急性毒性 | 口服 | 成年男性 | 30 mg/kg/1W-I | 行为毒性——头痛 |
6 | 急性毒性 | 口服 | 成年女性 | 9 mg/kg/36H-I | 行为毒性——出现幻觉,感知扭曲 |
7 | 急性毒性 | 口服 | 成年男性 | 87 mg/kg/4D-I | 行为毒性——兴奋 心脏毒性脉冲率发生变化 |
8 | 急性毒性 | 成年男性 | 714 mg/kg/5M-C | 心脏毒性——心率变化 | |
9 | 急性毒性 | 静脉注射 | 成年女性 | 27 mg/kg/8D-I | 行为毒性——出现幻觉,感知扭曲 |
10 | 急性毒性 | 多种途径 | 成年女性 | 174 mg/kg/33D-I | 肾、输尿管和膀胱毒性——肾小管发生变化 (包括急性肾功能衰竭,急性肾小管坏死) 肾、输尿管和膀胱毒性——间质性肾炎 |
11 | 急性毒性 | 口服 | 大鼠 | 4190 mg/kg | 行为毒性——嗜睡 行为毒性——惊厥或癫痫发作阈值受到影响 肺部、胸部或者呼吸毒性——呼吸困难 |
12 | 急性毒性 | 腹腔注射 | 大鼠 | 441 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
13 | 急性毒性 | 大鼠 | 1700 mg/kg | 详细作用没有报告除致死剂量以外的其他值 | |
14 | 急性毒性 | 静脉注射 | 大鼠 | 85 mg/kg | 行为毒性——嗜睡 行为毒性——惊厥或癫痫发作阈值受到影响 肺部、胸部或者呼吸毒性——紫绀 |
15 | 急性毒性 | 大鼠 | 1530 mg/kg | 详细作用没有报告除致死剂量以外的其他值 | |
16 | 急性毒性 | 口服 | 1100 mg/kg | 行为毒性——嗜睡 行为毒性——惊厥或癫痫发作阈值受到影响 肺部、胸部或者呼吸毒性——紫绀 | |
17 | 急性毒性 | 腹腔注射 | 小鼠 | 300 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
18 | 急性毒性 | 皮下注射 | 小鼠 | 630 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
19 | 急性毒性 | 静脉注射 | 小鼠 | 60 mg/kg | 行为毒性——嗜睡 行为毒性——惊厥或癫痫发作阈值受到影响 肺部、胸部或者呼吸毒性——紫绀 |
20 | 急性毒性 | 肌肉注射 | 小鼠 | 400 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
21 | 急性毒性 | 口服 | 狗 | 3 mg/kg | 行为毒性——惊厥或癫痫发作阈值受到影响 行为毒性——共济失调 胃肠道毒性——恶心、呕吐 |
22 | 急性毒性 | 口服 | 兔 | 2500 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
23 | 急性毒性 | 静脉注射 | 兔 | 109 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
24 | 慢性毒性 | 口服 | 大鼠 | 35 mg/kg/35D-C | 行为毒性——影响食物摄入量 (动物) 胃肠道毒性——唾液腺的结构或功能发生变化 肝毒性——肝重量发生变化 |
25 | 慢性毒性 | 口服 | 大鼠 | 111 mg/kg/53W-I | 肾、输尿管和膀胱毒性——尿中成分发生变化 |
26 | 慢性毒性 | 口服 | 狗 | 5600 mg/kg/5W-I | 血液毒性——红细胞染色异常或影响有核红细胞 血液毒性——血细胞计数发生变化 血液毒性——红细胞计数发生变化 |
27 | 慢性毒性 | 口服 | 狗 | 29120 mg/kg/26W-I | 肺部、胸部或者呼吸毒性——肺重量发生变化 血液毒性——红细胞计数发生变化 |
28 | 生殖毒性 | 口服 | 大鼠 | 50 mg/kg,雌性受孕 6-15 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——胚胎或胎儿死亡 |