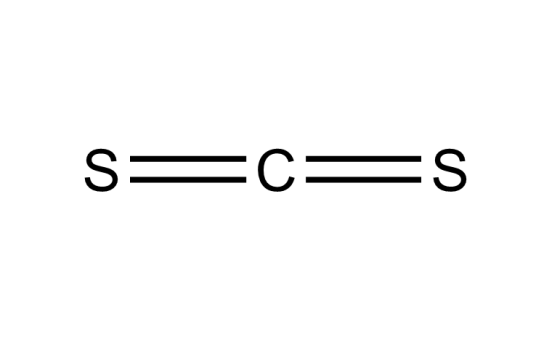-
二硫化碳 编辑
中文名:二硫化碳
外文名:CARBondisulfide
化学式:CS2
CAS登录号:75-15-0
EINECS登录号:200-843-6
熔点:-112至-111℃
沸点:46.2℃
水溶性:2.9g/L(20℃)
密度:1.266g/cm³
外观:无色液体
闪点:-30℃
应用:制造人造丝、杀虫剂、促进剂等,用作溶剂
安全性描述:S16;S33;S36/37;S45;S7;S26
危险性符号:F;T
危险性描述:R11;R36/38;R48/23;R62;R63
UN危险货物编号:1131
技术化学数据
二硫化碳是一种广泛性的酶抑制剂,具有细胞毒作用,可破坏细胞的正常代谢,干扰脂蛋白代谢而造成血管病变、神经病变及全身主要脏器的损害。
在常温常压下二硫化碳为无色透明微带芳香味的脂溶性液体,有杂质时呈黄色,少量天然存在于煤焦油与原油中,高纯品有愉快的甜味及似乙醚气味,一般试剂有腐败臭鸡蛋味,具有极强的挥发性、易燃性和爆炸性。燃烧时伴有蓝色火焰并被氧化成二氧化碳与二氧化硫。主要用于生产人造粘胶纤维(人造棉、人造毛)和粘胶薄膜,还用以制造四氯化碳、二硫代氨基甲酸铵、黄原酸酯、浮选矿剂、溶剂和橡胶硫化剂。二硫化碳也是硫、磷、硒、溴、碘、樟脑、树脂、蜡、橡胶和油脂等的良好溶剂,也是许多有机物进行红外光谱测定和氢质子核磁共振光谱测定用的溶剂。能大部分从呼吸道摄入体内,也可经皮肤吸收。摄入的有1/4经呼吸排出,少量由尿排出,其余经代谢转化。尿中的代谢产物是硫酸盐和存在对碘叠氮基反应具有阳性的物质,用此为二硫化碳暴露的生物指标。人吸入最低致死量为4000ppm (30分钟)。急性中毒时,初期兴奋、头痛,继而意识丧失、昏睡和死亡。低浓度长期暴露时,下肢出现多发性神经炎,伴有头痛、失眠、性欲减退和记忆力下降,脱离接触时能康复。长期暴露(例如10年)会发生视网膜症和肾疾患为特征的血管损伤。美国、日本规定大气最高容许浓度为10ppm (30mg/m3)。
物理性质
熔点:-112~-111℃
密度:1.266g/cm3
相对蒸气密度(空气=1):2.64
沸点:46.2℃
饱和蒸气压:53.32kPa(28℃)
燃烧热:1030.8kJ/mol
临界温度:279℃
临界压力:7.90MPa
闪点:-30℃
爆炸上限(V/V):60.0%
爆炸下限(V/V):1.0%
引燃温度:90℃
外观与性状:无色或淡黄色透明液体,纯品有乙醚味,易挥发
温度(℃) | 二硫化碳在水中(g) | 水在二硫化碳中(g) |
|---|---|---|
0 | 0.242 | —— |
10 | 0.230 | 0.0086 |
20 | 0.210 | 0.012 |
30 | 0.185 | 0.017 |
40 | 0.111 | 0.022 |
化学性质
性质 | 数值 | 温度(K) | 参考文献 | 状态 | |
|---|---|---|---|---|---|
热容CP | 77.8 | J/(mol·K) | 293 |
| l |
74.89 | J/(mol·K) | 294.81 |
| l | |
76.02 | J/(mol·K) | 297.43 |
| l | |
78.99 | J/(mol·K) | 298 |
| l | |
76.1 | J/(mol·K) | 301.2 |
| l | |
标准焓H(298.15K) | 116.94 | kJ/mol | 298.15 |
| g |
117.1 | kJ/mol | 298.15 |
| g | |
89.41 | kJ/mol | 298.15 |
| l | |
标准熵S(298.15K) | 151 | J/(mol·K) | 298.15 |
| l |
log(P) = A - B/(C+t) 其中:CP = 蒸气压 (bar);t= 温度 (℃) | |||||
温度范围 | A | B | C | 适用范围/℃ | 状 态 |
276.74~353.08 | 6.85145 | 1122.500 | 236.46 | -10~160 | g |
主要作为制造黏胶纤维、玻璃纸的原材料。用二硫化碳生产的黄原酸盐供作冶金工业的矿石浮选剂。用于生产农用杀虫剂。橡胶工业硫化时,可作为氯化硫的溶剂。用它制造氨处理系统中设备和管路的防腐蚀剂。也是检验伯胺、仲胺及α-氨基酸、测折射率、色谱分析用的溶剂。也用于从亚麻仁、橄榄果实、兽骨、皮革和羊毛中提取油脂。用作航空的润滑剂。二硫化碳是杀菌剂稻瘟灵、克菌丹、代森锰锌、代森锌、代森铵、福美双、福美锌、福美甲胂等的中间体,也是人造纤维的原料、橡胶硫化促进剂。二硫化碳是生产人造丝、赛璐玢、四氯化碳、农药杀菌剂、橡胶助剂的原料;在生产油脂、蜡、树脂、橡胶和硫磺等产品时,二硫化碳是优良的溶剂;可用作羊毛去脂剂、衣服去渍剂、金属浮选剂、油漆和清漆的脱膜剂、航空煤油添加剂等。
运输注意事项:二硫化碳液面上应覆盖不少于该容器容积1/4的水。铁路运输采用小开口铝桶、小开口厚钢桶包装时,须经铁路局批准。运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。夏季最好早晚运输。运输时所用的槽(罐)车应有接地链,槽内可设孔隔板以减少震荡产生静电。严禁与氧化剂、胺类、碱金属、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源、高温区。装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要禁止溜放。严禁用木船、水泥船散装运输。
储存注意事项:在室温下易挥发,因此容器内可用水封盖表面。储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。保持容器密封。应与氧化剂、胺类、碱金属、食用化学品分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
包装注意事项:小开口铝桶;小开口厚钢桶;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。
危险性概述
健康危害:二硫化碳是损害神经和血管的毒物。急性中毒:轻度中毒有头晕、头痛、眼及鼻粘膜刺激症状;中度中毒尚有酒醉表现;重度中毒可呈短时间的兴奋状态,继之出现谵妄、昏迷、意识丧失,伴有强直性及阵挛性抽搐。可因呼吸中枢麻痹而死亡。严重中毒后可遗留神衰综合征,中枢和周围神经永久性损害。慢性中毒:表现有神经衰弱综合征,植物神经功能紊乱,多发性周围神经病,中毒性脑病。眼底检查:视网膜微动脉瘤,动脉硬化,视神经萎缩。
燃爆危险:该品极度易燃,具刺激性。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如出现呼吸困难应立即就医处治。
食入:饮足量温水,催吐。就医。
消防措施
危险特性:极易燃,其蒸气能与空气形成范围广阔的爆炸性混合物。接触热、火星、火焰或氧化剂易燃烧爆炸。受热分解产生有毒的硫化物烟气。与铝、锌、钾、氟、氯、叠氮化物等反应剧烈,有燃烧爆炸危险。高速冲击、流动、激荡后可因产生静电火花放电引起燃烧爆炸。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。
有害燃烧产物:一氧化碳、二氧化碳、二氧化硫。
灭火方法:喷水冷却容器,可能的话将容器从火场移至空旷处。处在火场中的容器若已变色或从安全泄压装置中产生声音,必须马上撤离。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
泄漏应急处理
应急处理:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。应急处理人员应佩戴安全防护设备。不要直接接触泄漏物。尽可能切断泄漏源。防止流入下水道、排洪沟等限制性空间。
小量泄漏:用砂土、蛭石或其它惰性材料吸收。
大量泄漏:构筑围堤或挖坑收容。喷雾状水或泡沫冷却和稀释蒸汽、保护现场人员。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所进行无害化处理,污染现场,应急处置工具,清洗废水更应随之进行无害化处理至达到环保要求。
高浓度时具有麻醉作用。可通过呼吸道及皮肤侵害人体机能,对生物有剧毒。对人体中毒机理,主要使中枢神经中毒引起神经系统疾病。中毒者的处理,是应尽快脱离现场,移至通风良好处,呼吸衰弱者需立即进行人工呼吸。
编号 | 毒性类型 | 测试对象 | 使用剂量 | 毒性作用 | |
|---|---|---|---|---|---|
1 | 急性毒性 | 吸入 | 人类 | 4000 ppm/30M | 详细的毒副作用没有报告以外的其他致死剂量值 |
2 | 急性毒性 | 吸入 | 人类 | 2000 ppm/5M | 详细的毒副作用没有报告以外的其他致死剂量值 |
3 | 急性毒性 | 未知 | 男性 | 186 mg/kg | 详细的毒副作用没有报告以外的其他致死剂量值 |
4 | 急性毒性 | 口服 | 啮齿动物- 大鼠 | 1200 mg/kg | 详细的毒副作用没有报告以外的其他致死剂量值 |
5 | 急性毒性 | 吸入 | 啮齿动物- 大鼠 | 25 gm/m3/2H | 详细的毒副作用没有报告以外的其他致死剂量值 |
6 | 急性毒性 | 口服 | 啮齿动物- 鼠 | 2780 mg/kg | 详细的毒副作用没有报告以外的其他致死剂量值 |
7 | 急性毒性 | 吸入 | 啮齿动物- 鼠 | 10 gm/m3/2H | 详细的毒副作用没有报告以外的其他致死剂量值 |
8 | 急性毒性 | 口服 | 啮齿动物- 兔 | 2550 mg/kg | 详细的毒副作用没有报告以外的其他致死剂量值 |
9 | 急性毒性 | 口服 | 啮齿动物- 豚鼠 | 2125 mg/kg | 详细的毒副作用没有报告以外的其他致死剂量值 |
10 | 急性毒性 | 腹腔注射 | 啮齿动物- 豚鼠 | 400 mg/kg | |
11 | 急性毒性 | 吸入 | 哺乳动物- 未指定 | 2000 ppm/5M | 详细的毒副作用没有报告以外的其他致死剂量值 |
12 | 多次剂量 | 口服 | 啮齿动物- 大鼠 | 5055 mg/kg/4W-I | 营养和代谢系统毒性——体重减轻或体重增加下降 |
13 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 10 mg/m3/5H/13W-I | 大脑毒性——其他退化 内分泌毒性——其他变化 |
14 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 2000 ppm/4H/2W-I | 行为毒性——心理、生理变化 慢性病相关毒性——死亡 |
15 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 114 mg/m3/8H/20W-I | 肾、输尿管和膀胱毒性——包括急性毒性肾功能衰竭,急性毒性肾小管坏死 慢性病相关毒性——死亡 |
16 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 800 ppm/6H/12W-I | 营养和代谢系统毒性——体重减轻或体重增加下降 生化毒性——抑制其他酶活性 |
17 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 1500 mg/m3/5H/26W-I | 生化毒性——抑制磷酸酶 生化毒性——抑制其他酶活性 生化毒性——新陈代谢、血液运输异常 |
18 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 800 mg/m3/5H/1Y-I | 生化毒性——抑制磷酸酶 生化毒性——抑制其他酶活性 |
19 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 100 mg/m3/17W-I | 心脏毒性——冠状心脏变化 血管毒性——血管结构变化 |
20 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 500 ppm/24H/25W-C | 周围神经毒性——传出神经异常 营养和代谢系统毒性——体重减轻或体重增加下降 |
21 | 多次剂量 | 吸入 | 啮齿动物- 大鼠 | 800 ppm/6H/15W-I | 大脑毒性——中枢神经系统异常 营养和代谢系统毒性——体重减轻或体重增加下降 |
22 | 多次剂量 | 腹腔注射 | 啮齿动物- 大鼠 | 3 mg/kg/3D-I | 脊髓神经毒性——其他脊髓退行性改变 |
23 | 多次剂量 | 腹腔注射 | 啮齿动物- 大鼠 | 6475 mg/kg/4W-I | 大脑毒性——其他退行性改变 行为毒性——嗜睡 行为毒性——激动 |
24 | 多次剂量 | 腹腔注射 | 啮齿动物- 大鼠 | 5600 mg/kg/35D-I | 心脏毒性——其他变化 血管毒性——血管结构变化 |
25 | 多次剂量 | 口服 | 啮齿动物- 鼠 | 5512 mg/kg/5D-I | 内分泌毒性——胸腺重量的变化 营养和代谢系统毒性——体重减轻或体重增加下降 慢性病相关毒性——死亡 |
26 | 多次剂量 | 吸入 | 啮齿动物- 鼠 | 114 mg/m3/8H/20W-I | 胃肠道毒性——其他变化 营养和代谢系统毒性——体重减轻或体重增加下降 慢性病相关毒性——死亡 |
27 | 多次剂量 | 吸入 | 哺乳动物- 狗 | 1250 mg/m3/8H/11W- | 大脑毒性——无明显变化 眼毒性——无明显变化 心脏毒性——心电图改变 |
28 | 多次剂量 | 吸入 | 灵长目动物- 猴 | 1200 mg/m3/6H/20W-I | 内分泌毒性——高血糖 血液毒性——血清中成分的改变(例如TP,胆红素,胆固醇) |
29 | 多次剂量 | 吸入 | 灵长目动物- 猴 | 160 ppm/6H/36D | 眼毒性——无明显变化 |
30 | 多次剂量 | 口服 | 啮齿动物- 兔 | 25298 mg/kg/26W-I | 心脏毒性——心脏重量的变化 内分泌毒性——高血糖 |
31 | 突变毒性 | 100 μL/plate | |||
32 | 突变毒性 | 人类淋巴 | 8 mg/L | ||
33 | 突变毒性 | 人类淋巴 | 10200 μg/L | ||
34 | 生殖毒性 | 吸入 | 男人 | 40 mg/m3,male 91 week(s) pre-mating | |
35 | 生殖毒性 | 口服 | 啮齿动物- 大鼠 | 2 mg/kg,female 6-15 DAy(s) after conception | |
36 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 200 mg/m3/24H,female 1-21 day(s) after conception | |
37 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 10 mg/m3/8H,female 1-22 day(s) after conception | 生殖毒性生殖毒性——眼睛/耳朵发育异常 生殖毒性生殖毒性——新生儿活力异常 |
38 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 100 mg/m3/8H,female 1-22 day(s) after conception | 生殖毒性生殖毒性——新生儿体重增加缓慢 |
39 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 100 mg/m3/8H,female 1-21 day(s) after conception | 生殖毒性生殖毒性——胎儿死亡 生殖毒性生殖毒性——颅面发育异常(包括鼻,舌) 生殖毒性生殖毒性——发育异常 |
40 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 30 μg/m3/8H,female 1-22 day(s) after conception | 生殖毒性生殖毒性——新生儿行为异常 |
41 | 生殖毒性 | 吸入 | 啮齿动物- 大鼠 | 600 ppm/6H,male 50 day(s) pre-mating | |
42 | 生殖毒性 | 吸入 | 啮齿动物- 鼠 | 2000 mg/m3/2H,female 1-21 day(s) after conception | 生殖毒性生殖毒性——胚胎植入前的死亡率增加 生殖毒性生殖毒性——产仔数下降 |
43 | 生殖毒性 | 吸入 | 啮齿动物- 鼠 | 10 mg/m3/2H,female 3 week(s) pre-mating | 生殖毒性生殖毒性——生育能力下降 |
44 | 生殖毒性 | 口服 | 啮齿动物- 兔 | 350 mg/kg,female 6-19 day(s) after conception | 生殖毒性生殖毒性——植入后死亡率增加 |
45 | 生殖毒性 | 口服 | 啮齿动物- 兔 | 2100 mg/kg,female 6-19 day(s) after conception | 生殖毒性生殖毒性——其他发育异常 |
二硫化碳是一种常见的溶剂和化工原料,工业上广泛用于生产粘胶纤维、玻璃纸、四氯化碳 、农药和橡胶的硫化等。在生产和使用过程中产生的大气量、低浓度的CS2 废气,高毒、易燃、易爆,对环境和人体健康危害极大。为了保护环境和人体健康,控制CS2的排放是非常必要的 。
二硫化碳的危害
二硫化碳对环境的危害
CS2的化学反应活性较低,但在平流层中通过光化学反应,易被氧化成SO2,导致酸雨的形成。因此 CS2对大气环境所造成的危害是不容忽视的。
二硫化碳对工业生产的危害
CS2对工业生产也有很大危害。CS2缓慢水解生成硫化氢,腐蚀生产设备,造成经济损失;同时毒害下游工业的催化剂,如合成甲醇、烷基化过程及合成氨等的催化剂。
二硫化碳对人体的危害
CS2是一种多系统亲和毒物,对神经、心血管、生殖、胃肠道、泌尿等系统均有毒害作用。CS2主要经呼吸道进入人体,高浓度时皮肤亦可吸收。吸入人体后的CS2广泛分布于肝、肾、脑、肺、脂肪、肌肉、脾、心、肾上腺等器官中,其中在肝、肾组织中含量最高,脑组织中含量最低,但驻留时间最长,中毒主要表现为中枢和外周神经损害。CS2不仅能引起神经、心血管等系统的病变,导致高血压、冠心病、记忆力减退和失眠等,而且对生殖系统也有毒害。有文献报道,CS2具有胚胎毒性和生殖毒性,对接触女工月经也有影响。CS2可导致胚胎发育障碍和子代先天缺 陷,而且这种致畸作用可隔代遗传。
二硫化碳治理技术
CS2废气的治理技术历经多年的发展,已经形成一些卓有成效的方法 。
冷凝法
CS2的沸点为46.3℃,液化温度低,所以采用冷凝法回收CS2是一种既经济又方便的方法。废气中CS2含量越高,冷却温度越低,则回收效果越好。
有些厂家采用常温水(自来水)冷却回收CS2,然后将废气直接从排毒塔排出,这种方法的回收率较低。比较合理的方法是采用多级列管加填料(例如瓷环)冷却回收CS2。此方法冷却面积大,冷却效率高,费用较低。其基本流程是:先将CS2废气经常温水(自来水)冷却(一级),再经冷冻水冷却(二 、三级),CS2及水蒸气等可凝性气体被冷凝下来,再进行提纯回收,经这种方法处理后CS2的回收率大约能提高20%左右。
吸附法
采用吸附法处理CS2废气需要吸附性能良好且成本低廉的吸附剂,最常用的吸附剂是活性炭。活性炭吸附CS2属于以物理吸附为主的放热吸附,低温有利于吸附,温度对活性炭的平衡吸附量有负效应,而且影响相当严重。活性炭吸附CS2主要在微孔中进行,吸附量与吸附剂比表面积和微孔体积有关。
水分对活性炭吸附CS2的能力有影响,因为活性炭对CS2与水蒸气的吸附具有明显的选择性,当水分超过6% ~ 8%(w)时,CS2的吸附量急剧下降。
活性炭吸附CS2的一般流程为CS2废气通过活性炭床层时CS2被吸附,当活性炭吸附达到饱和时,利用CS2沸点低(46.3 ℃)的特性,加热使其解析出来,再冷凝回收。也可用蒸汽直接解析,解析后的活性炭经干燥、冷却后可重新使用。
对活性炭吸附CS2的研究较多而对活性炭纤维(ACF)吸附CS2的报道较少。ACF 具有比表面积大、微孔数量多、孔径分布窄、吸附速度快、再生能力强等特点在最近倍受关注。ACF对CS2的吸附性能比活性炭优越,且使用方便,吸附量大。
完全氧化法
完全氧化法包括催化氧化法和热力燃烧法,后者需用大量外加燃料燃烧来供热,使废气温度提高到CS2的完全氧化温度。催化氧化法在一定条件下要优于热力燃烧法。
热力燃烧法是CS2废气在热交换器中预热后,进入热力燃烧室进行燃烧的方法。该方法的主要原理是使废气中的 CS2和O2反应生成SO2进而转化成SO3,经吸附或冷凝成为H2SO4。
催化氧化法是将CS2废气加热后,在催化剂床层作用下,CS2在较低温度和较短时间内被氧化为SO2,再冷凝为浓硫酸的方法。常用的催化剂有 Al -Mn、Pt、Ti等 。该方法既能便于硫的除去和回收,又不会产生二次污染 。世界上较具代表性的是丹麦托普索 (Topsoe)公司的WSA法和瑞士毛雷尔公司的 KVT-SUIFOX法。两者的反应机理相似。
湿式氧化法
1、螯合铁氧化法
螯合铁氧化法是近年来的一项重要研究课题,工业上已广泛用于脱除H2S,如果加以改进,则可用来脱除CS2。将丙二醇、异丙醇等醇类作为增溶剂加入到 EDTA螯合铁溶液中,可促进难溶于水的CS2的溶解。实验表明,在 EDTA-Fe浓度为0.2 mol/L,醇含量(按体积计算)约为30%的条件下,CS2的脱除率可达96%,但此反应需在较高压力下进行。
2、溴水吸收——电解法
有实验在洗涤塔中采用溴水吸收化纤加工过程中产生的CS2废气,得到HBr和H2SO4,然后电解 HBr,再生循环, 吸收液经浓缩后可得到浓H2SO4。此法回收利用率高,可得到 H2、H2SO4等副产品,且Br2可循环使用,但运转费用较高,对设备防腐要求较高。
化学吸收转化法
此法是通过化学反应将CS2转化吸收从而达到脱除的一种方法。例如MZX高温有机硫转化吸收型精脱硫剂,采用多种金属氧化物复合,添加一定比例的粘合剂挤压成型后,再浸渍活性组分后干燥焙烧而成。
MZX精脱硫剂可以有效地将CS2转化并脱除,反应温度为350~450 ℃,MZX精脱硫剂脱硫操作简单,费用较低,在工业上可取代传统的钴钼加氢串联氧化锌的工艺,具有良好的工业应用前景。 同时EZ-2宽温氧化锌精脱硫剂将CS2转化吸收,并且可在常温至400℃的宽温区下使用。其脱硫精度高,能有效保护下游生产中对硫敏感的催化剂,解决了设备硫腐蚀和催化剂中毒问题,经济效益显著。
KDS-I型吸收剂是能在常温常压下脱除CS2的转化吸收型脱硫剂,此脱硫剂是由胺负载到硅酸钙载体上制备的,在45 ℃时KDS-I型吸收剂对CS2的脱除率可达70%以上。
催化加氢或催化水解法
催化加氢脱硫剂是采用具有加氢功能的物质作为活性组分浸渍到Al2O3或者Al2O3/SiO2载体上构成加氢催化剂。其活性组分主要有WNi、MoNi、MoCo、MoCoNi、WmoNi、WmoNiCo等,有时掺 入少量 P、B、F等助剂。催化加氢法脱除CS2是在300~400℃使用 CO-MO/Al2O3催化剂通过加氢生成 H2S 。
反应生成的硫化氢经串联固定床反应器脱除。催化水解CS2在反应温度200~300 ℃进行,能耗相对较低,副反应较少。CS2在催化剂上水解转化为硫化氢,然后硫化氢被氧化铁或活性炭脱硫剂吸附脱除。水解催化剂通常采用活性氧化铝。
研究了氧化铝基上CS2的水解反应性,有认为CS2催化水解反应为碱催化反应,碱性有利于CS2的水解。有学者指出弱的表面碱性中心是CS2水解活性中心,同时次弱的碱性中心也参与CS2水解。
低温催化水解可以进一步节能降耗和减少副反应的发生。有学者对低温下催化水解-氧化耦合一步法脱除CS2的可行性进行了研究。即在降低CS2水解温度的同时,也能将生成的硫化氢脱除。催化水解-氧化耦合是在一个反应器内,使用双功能催化剂或两种不同功能的催化剂,将原料气经催化合成中间产物,再进一步催化合成最终产物。在CS2 的脱除中,应用了具有水解和氧化双功能的催化剂,实现了一步法脱除CS2。
首先 CS2 在催化剂的水解中心水解生成中间产物硫化 氢,然后硫化氢在氧化中心被氧化生成单质硫和硫 酸盐而沉积于催化剂上 。通过研究 , 得出此方法在低温 (100 ~ 130 ℃)下脱除 CS2 是可行的 。
等离子体法
等离子体法处理CS2废气主要处于实验室研究阶段,其基本原理是:通过陡前沿、窄脉宽(纳秒级)的高压脉冲电晕放电或通过电场加速作用,在常温常压下产生非平衡等离子体,即高能电子、O· 、OH·等活性粒子,对CS2分子进行氧化、降解反应,使其最终转化为CO2、SO2。
光分解法
光分解CS2有两种形式:一种是用特定波长的光直接照射使CS2分解;另一种是在催化剂存在下,光照使CS2分解。 直接光降解法中CS2可直接吸收特定波长的光辐射而被分解,同时废气中的氧气和水蒸汽也能吸收辐射产生具有较强氧化能力的羟基和高能氧原子,这些自由基可以引起CS2的氧化反应。
光催化降解CS2的基本原理是在一定波长的光照射下,光催化剂(如常用的TiO2)被激活,使H2O生成羟基自由基,然后羟基自由基将CS2氧化降解。
生物法
生物法利用微生物的生命活动处理CS2废气,具有投资省、运行费用低、较少产生二次污染等优点 。生物法的关键在于填料的选择和脱硫微生物的选择与培养 。因为降解CS2的菌株不易培养驯化,对生物法处理CS2的研究文献不是很多。
曾报道过降解CS2的菌株研究结果,但只报道了一种可用于CS2降解的菌株。 生物法处理CS2废气主要是应用噬硫杆菌群的生化作用,应用最为广泛的菌种是排硫杆菌(ThiobacillusYhioparus)、氧化硫杆菌(ThioXidans)等。微生物通过一系列生化反应将废气中的CS2转化为无害的CO2气体、单质硫或硫酸盐,同时在氧化过程中获得能量,并以CS2为碳源合成细胞成分。
在国内,生物法处理CS2废气还处于研究阶段,还未开发出生物法处理的工艺和装备。在国外,意大利斯尼亚公司和奥地利兰精公司都拥有应用微生物工程治理粘胶纤维工业废气中H2S和CS2的技术。两家公司的工艺流程很相似:首先将废气泵入生化塔,在生化塔中利用噬硫杆菌群将废气中的H2S、CS2吸收转化为硫或硫酸盐,进而稀释成硫酸回收,净化后的气体直接排放,废气中其他杂质通过生化塔后的过滤器滤除,清液经补水和调温后回用。
上一篇 子宫内膜异位症手术的风险有哪些?
下一篇 网脉橐吾

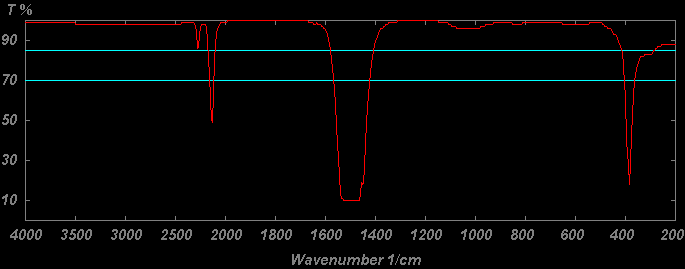 红外光谱图
红外光谱图