-
硝酸根 编辑
硝酸根(nitrate)
1.定义:一般地,硝酸根是指硝酸盐的阴离子。
2.化学式:NO3-,硝酸根为-1价,其中N为最高价+5价
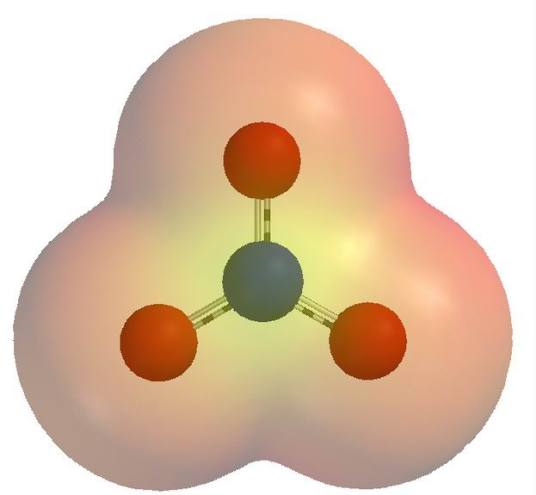
3.结构式: :O=N-O2
4.离子结构:N原子以sp²杂化轨道成键、离子中存在3个σ键,离子为平面三角形。
5.氧化性离子:硝酸根在酸性环境下显强氧化性。例如硝酸和铜反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
硝酸与非金属反应
C+4HNO3(浓)
S+4HNO3(浓)
P+5HNO3(浓)
3P+5HNO3(稀)+2H2O
相对分子质量:62
目的:认识检验硝酸根离子的方法。
用品:试管、试管架、试管夹、量筒。
原理:硝酸根离子有氧化性,在酸性溶液中能使亚铁离子氧化成铁离子,而自己则还原为一氧化氮。一氧化氮能跟许多金属盐结合生成不稳定的亚硝基化合物。它跟硫酸亚铁反应即生成深棕色的硫酸亚硝基铁:
3Fe2++NO3-+4H+=3Fe3++2H2O+NO
FeSO4+NO=Fe(NO)SO4
实验室里常利用这个反应检验硝酸根离子,称为棕色环实验。这种简单亚硝基化合物只存在于溶液内,加热时,一氧化氮即从溶液内完全逸出。
亚硝酸根离子也能发生类似的反应。要区别这两种酸根离子可以用浓磷酸,亚硝酸根离子能显现深棕色而硝酸根离子却不能。
准备和操作:往试管里注入3毫升1mol/L的硝酸钾溶液和3mL1mol/L的硫酸亚铁溶液,振荡试管,混和均匀。斜持试管,沿试管壁慢慢注入浓硫酸3mL,使密度较大的浓硫酸沉入试管的底部,跟硝酸钾和硫酸亚铁的混和溶液分成两层。稍待片刻,把试管慢慢竖直,不久,两层液体间就有一个棕色的环生成。
注意事项:硫酸亚铁必须是新制备的,硫酸必须是浓的。操作时不能把溶液冲浑。
其它实验方法:适用于固态的硝酸盐或相当浓的硝酸盐溶液。把少量的硝酸盐晶体或浓溶液置于试管内,然后加入少量浓硫酸(1∶1)。再向试管内加入一小块铜片。给试管加热,有红棕色气体产生,则证明含有硝酸根离子。
Cu+2NO3-+2H2SO4=CuSO4+2NO2↑+2H2O+SO42-