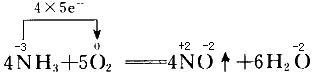-
化学变化 编辑
化学变化(chemical change)在生产和生活中普遍存在。产生了新物质的变化是化学变化。如铁的生锈、节日的焰火、酸碱中和,镁条的燃烧等等。宏观上可以看到各种化学变化都产生了新物质,这是化学变化的特征。总结:有新物质产生的变化即为化学变化。
化学变化种类较多,可根据不同方面将其分类。
种类及数量
从反应物和生成物的种类及数量进行划分,可以把化学变化分为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。
(1)化合反应:S+O2=点燃=SO2;
(2)分解反应:2H2O=通电=2H2↑+O2↑;
(3)置换反应:H2+CuO=高温=Cu+H2O;
(4)复分解反应:HCl+AgNO3=AgCl↓+HNO3。
升降变化
若从反应中元素化合价的升降变化的角度,可以分为氧化还原反应和非氧化还原反应。其中氧化还原反应又分为氧化反应和还原反应。氧化还原反应的实质是发生了电子的转移或偏离。
氧化反应:
还原剂(反应物)→失电子或共用电子对偏离→化合价升高→被氧化→发生氧化反应→生成氧化产物。
还原反应:
氧化剂(反应物)→得电子或共用电子对偏向→化合价降低→被还原→发生还原反应→生成还原产物。
氧化-还原反应(oxiDAtion-reduCTion reaction,,也作redox reaction)是化学反应前后,元素的氧化数有变化的一类反应。氧化还原反应的实质是电子的得失或共用电子对的偏移。氧化还原反应是化学反应中的三大基本反应之一,另外两个为(路易斯)酸碱反应与自由基反应。自然界中的燃烧、呼吸作用、光合作用、生产生活中的化学电池、金属冶炼、火箭发射等等都与氧化还原反应息息相关。研究氧化还原反应,对人类的进步具有极其重要的意义。
是否有离子参加
若从反应中是否有离子参加的角度看,可分为离子反应和非离子反应。离子反应的本质是某些离子浓度发生改变。离子反应的本质是某些离子浓度发生改变。常见离子反应多在水溶液中进行。有离子参加的化学反应,根据反应原理,离子反应可分为复分解、盐类水解、氧化还原、络合4个类型;也可根据参加反应的微粒,分为离子间、离子与分子间、离子与原子间的反应等。极浓的电解质跟固态物质反应时,应根据反应的本质来确定是否属于离子反应。例如,浓硫酸跟铜反应时,表现的是硫酸分子的氧化性,故不属于离子反应;浓硫酸跟固体亚硫酸钠反应时,实际上是氢离子跟亚硫酸根离子间的作用,属于离子反应。此外,离子化合物在熔融状态也能发生离子反应。
能量变化
若从反应的能量变化的角度看可分为吸热反应和放热反应。
在化学反应中,反应物总能量大于生成物总能量的反应叫做放热反应。包括燃烧、中和、金属氧化、铝热反应、较活泼的金属与酸反应、由不稳定物质变为稳定物质的反应。
吸热反应指的就是化学上把最终表现为吸收热量的化学反应。吸热反应中反应物的总能量低于生成物的总能量。吸热反应的逆反应一定是放热反应。
实质
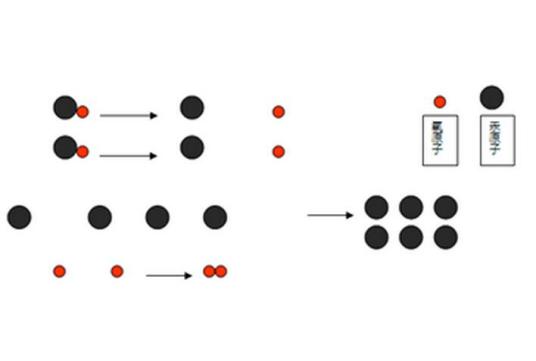
从微观上可以理解化学变化的实质:化学反应前后原子的种类、个数没有变化,仅仅是原子与原子之间的结合方式发生了改变,原子是化学变化的最小微粒。例如对于分子构成的物质来说,就是原子重新组合成新物质的分子。物质的化学性质需要通过物质发生化学变化才能表现出来,因此可以利用使物质发生化学反应的方法来研究物质的化学性质,制取新的物质。
实例
化学变化常伴有光、热、气体、沉淀产生或颜色气味改变等表现现象发生,可以参照这些现象来判断有无化学反应发生。但要注意跟物理变化的区别。物理变化也常伴有发光(电灯)、放热(摩擦)、放出气体(启开汽水瓶盖)、颜色变化(氧气变成液氧)、产生沉淀物(明矾净水)等,只是没有新物质生成,这是物理变化与化学变化的根本区别。根据反应物、生成物种类不同可以把化学反应分为化合、分解、置换和复分解4种基本类型。也可以从其他角度给化学反应分类,如分成氧化还原反应与非氧化还原反应;吸热反应与放热反应等等。物体在化学变化中表现出来的性质是化学性质。化学变化里一定包含物理变化,物理变化里一定没有化学变化。燃烧必然伴随发光、放热的现象,但是不一定有火焰。如果是可燃性气体燃烧,就会产生火焰,如:氢气、一氧化碳、甲烷的燃烧,硫磺和蜡烛在燃烧时会产生硫蒸气和石蜡蒸气,也有火焰;但是木炭在燃烧过程中始终是固态,不能产生可燃性蒸气,所以没有火焰。其中,爆炸较复杂,有两种情况。一种是由于燃烧放热散不掉,在有限空间内体积膨胀产生的爆炸,它是化学变化,例如:H2与O2混合点燃爆炸,爆竹爆炸等;另一种是由于气压引起的爆炸,例如:气球爆炸,轮胎爆炸等,是物理变化。吸热反应和放热反应可通过反应条件判断。“点燃”为放热;“高温”为吸热。有些反应中条件还需“催化剂”才能进行,但不论什么反应,都必然遵守质量守恒定律。
上一篇 老鼠吹箫
下一篇 纵隔肿瘤常规治疗方式是什么?