-
弗隆 编辑
弗隆(来曲唑片),适应症为对绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性或受体状态不明。对已经接受他莫昔芬辅助治疗5年的、绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性或受体状态不明。治疗绝经后、雌激素受体阳性孕激素受体阳性或受体状态不明的晚期乳腺癌患者,这些患者应为自然绝经或人工诱导绝经。
对已经接受他莫昔芬辅助治疗5年的、绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性或受体状态不明。
治疗绝经后、雌激素受体阳性孕激素受体阳性或受体状态不明的晚期乳腺癌患者,这些患者应为自然绝经或人工诱导绝经。
对于已经接受他莫昔芬辅助治疗5年的患者,应连续服用本品直到病情复发。
本品的推荐剂量为2.5mg,每日一次。服用时可不考虑进食时间(见【药代动力学】-吸收)。对于晚期乳腺癌,本品的治疗应持续到证实肿瘤出现进展时为止。
临床试验中最常见的不良反应为热潮红,关节痛、恶心和疲劳。很多不良反应是因为雌激素缺乏所致的正常药理作用(如,热潮红、脱发和阴道出血)。表1列出的不良反应来源于临床研究和上市后报告。
表1
不良反应按照发生的频率分类,首先是最常发生的,使用以下习惯表达:很常见:≥1/10;常见:≥1/100,<1/10;不常见:≥1/1000,<1/100;少见:≥1/10,000,<1/1000;罕见:<1/10,000
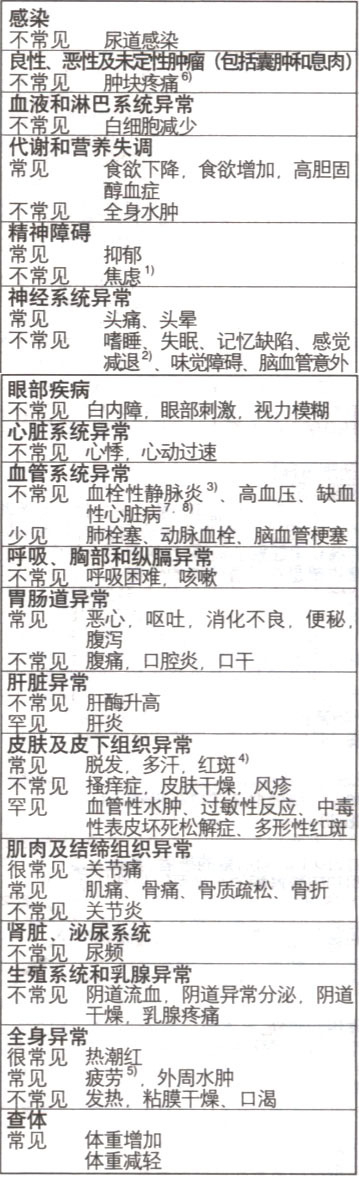 不良反应按照发生的频率分类
不良反应按照发生的频率分类
(3)包括浅表或深部血栓性静脉炎
(5)包括乏力、不适
(6)仅在转移/新辅助治疗中出现
(7)在辅助治疗中,不考虑因果关系,来曲唑和他莫昔芬组发生下列不良反应的频率分别为:血栓(2.1%vs.3.6%)、心绞痛(1.1%vs1.0%)、心肌梗塞(1.0%vs.0.5%)、心力衰竭(0.8%vs.0.5%)。
(8)在后续强化辅助治疗的情况下,中位治疗持续时间来曲唑组是60个月,安慰剂组是37个月,下列不良反应被分别报告于来曲唑和安慰剂(不包括换用来曲唑的患者):新发生或加重的心绞痛(1.4%比1.0%);需要手术治疗的心绞痛(0.8%比0.6%);心肌梗塞(1.0%比0.7%);血栓栓塞事件(0.9%比0.3%);卒中/一过性缺血(1.5%比0.8%)。
对于绝经状态不明的患者,在治疗之前须检查患者的LH、FSH和/或雌二醇水平从而确定其绝经状态。
本品不得与其它含雌激素的药物同时使用,因为雌激素会抵消本品的药理作用。
本品可降低血液循环中的雌激素水平,长期使用可能导致骨密度降低。
对于患有骨质疏松症或具有骨质疏松风险的妇女,在使用本品进行辅助治疗之前,应使用骨密度剂量仪对骨密度进行评估,之后须定期检查。
建议在治疗期间检测总体骨骼健康,如有必要应随时检查,从而防止或治疗骨质疏松症,应密切观察出现问题的患者。
肾功能不全
没有在肌酐清除率,安慰剂组62例),总体上,两组无显著性差异。(风险比0.82;P=0.292;CI95%:0.56,1.19)。在风险较高的淋巴结阳性患者中,来曲唑显著地降低死亡风险约40%(风险比0.61;P=0.035;CI95%:0.38,0.97),对淋巴结阴性患者两组无显著性差异(风险比1.36;P=0.385;CI95%:0.68,2.71)。
更新分析中,与安慰剂组相比,尽管安慰剂组60%的患者换用了来曲唑,来曲唑组对侧侵袭性乳腺癌的几率显著降低。总生存无显著差异。
转换用药日截尾随访时间的探索性分析显示,全因死亡风险来曲唑组显著低于安慰剂组。
在大于等于65岁和65岁以下患者的安全性和有效性均无显著性差异。
以下不良反应中,来曲唑组的发生率明显高于安慰剂组:热潮红(49.7%对43.3%),关节疼痛/关节炎(27.7%对22.2%)和肌痛(9.5%对6.7%)。来曲唑组骨质疏松的发生率高于安慰剂组(6.9%对5.5%),临床骨折的发生率稍高于安慰剂组(5.9%对5.5%)。
从骨密度研究(中位随访时间18个月)的初步结果可看出:相比于基线,服用来曲唑的患者髋骨密度平均降低3%,而安慰剂组为0.4%(P=0.048)。脊椎骨的骨密度来曲唑组降低4.6%,安慰剂组降低2%,但无显著性差异。来曲唑组中新诊断的骨质疏松症为5.7%,安慰剂组为4.5%(P=0.07)。一些患者用钙和双磷酸盐治疗。
脂质更新研究结果显示(中位随访时间62个月),来曲唑与安慰剂组无显著性差异。两组心血管缺血性事件的发生率分别为9.8%和7.8%,有统计学显著性。
在生活质量分析(SF-36)中,来曲唑和安慰剂组在身体健康,疼痛和活动性方面无临床相关差异。
一线治疗
一项来曲唑和他莫昔芬作为一线治疗的对照研究在907例局部晚期或转移性乳腺癌患者中进行,分析显示来曲唑在以下几项研究指标上优于他莫昔芬:疾病进展时间作为主要指标,中位疾病进展时间为9.4月个对6.0个月(风险比为0.7,p=0.0001);总的客观缓解率(CR+PR),30%对20%(比值比1.71,p=0.001);治疗失败时间方面,9.1月对5.7月(P=0.0001)。
无论在激素受体(+)还是在受体情况不明的患者亚群中,来曲唑在客观缓解率和疾病进展时间方面均优于他莫昔芬。
在既往接受过抗雌激素治疗的患者亚群中,来曲唑在缓解率和疾病进展时间方面仍优于他莫昔芬。
在年龄大于70岁的患者中,来曲唑组在疾病进展时间方面显著优于他莫昔芬治疗组为12.2月对5.8月(风险比为0.72,p=0.0001),并且来曲唑治疗组获得客观缓解率的机会也显著高于对照组(比值比1.68,p=0.0009)。
在生存期上,来曲唑有明显优势(40个月∶30个月)。
二线治疗
两项在绝经后、既往接受过抗雌激素治疗的晚期乳腺癌患者中进行的对照研究分别对比了两种剂量的来曲唑(0.5mg和2.5mg)与醋酸甲地孕酮和安鲁米特的疗效。
2.5mg的来曲唑与醋酸甲地孕酮相比,在缓解率(24%对16%,p=0.04)和治疗失败时间(p=0.04)方面均显示了统计学上的显著性差异。疾病进展时间在2.5mg来曲唑治疗组和甲地孕酮组无显著性差异(p=0.07),总生存率在两治疗组无显著性差异(p=0.2)。
在第二项研究中,2.5mg来曲唑与安鲁米特相比在缓解率方面无显著性差异(p=0.06)。
2.5mg来曲唑治疗组在疾病进展时间(p=0.008)、治疗失败时间(p=0.003)和总生存(p=0.002)等方面均显著优于安鲁米特治疗组。
由于乳腺肿瘤组织的生长依赖于雌激素的存在,因此消除雌激介导的刺激作用是肿瘤获得缓解的前提。在绝经后女性中,雌激素主要是在芳香化酶的作用下产生的,它可将肾上腺产生的雄激素,主要是雄烯二酮和睾丸酮转化为雌酮(E1)和雌二醇(E2)。因此可以通过特异性地抑制芳香化酶而抑制雌激素在周围组织和肿瘤组织本身中的生物合成。
来曲唑是一种选择性的、非甾体类的芳香化酶抑制剂,它可以竞争性地与细胞色素P450酶的亚单位的血红素结合,从而抑制芳香化酶,导致雌激素在所有组织中的生物合成减少。
在健康绝经后女性中,单次应用0.1、0.5、2.5 mg的来曲唑,可以分别从基线水平将雌酮和雌二醇的血清浓度降低75-78%和78%。在48-78小时可达到最强效果。
在绝经后晚期乳腺癌患者中,所有接受每日0.1-5 mg剂量的患者,其血浆雌二醇、雌酮和硫酸雌酮的水平可以分别从基线水平下降75-95%。当剂量达到0.5 mg或更高时,很多雌酮和硫酸雌酮的值低于检测限,表明在此剂量水平可能得到更高的抑制率。在所有接受治疗的患者中,药物在治疗过程中对雌激素生物合成的抑制作用一直保持存在。
未观察到对肾上腺皮质激素合成的抑制作用。绝经后患者每日接受0.1-5 mg来曲唑治疗后,无论是可的松、醛固酮、11-脱氧可的松、17-羟孕酮和ACTH的血浆浓度,还是血浆肾素活性均无临床上的相关改变。健康绝经后女性接受每日0.1、0.25、0.5、1、2.5和5 mg来曲唑治疗6周和12周后,ACTH刺激实验显示醛固酮或可的松的合成没有减少。因此,不必补充糖皮质激素和盐皮质激素。
健康绝经后女性接受单次0.1、0.5和2.5 mg来曲唑后,血浆中雄激素浓度(雄烯二酮和睾丸酮)未发现变化 ;绝经后患者接受每日0.1-5 mg来曲唑治疗后,血浆中雄烯二酮的浓度也未发现变化。这表明,抑制雌激素的生物合成并不会导致雄激素前体的聚集。患者接受来曲唑治疗对血浆LH和FSH的水平并无负面影响,通过TSH、T4和T3的摄取实验证实,它同样不会对甲状腺功能产生影响。
毒理研究
对幼年大鼠进行的研究中,来曲唑的药理作用引起骨骼、神经内分泌和生殖系统改变。
雄性大鼠自最低剂量(0.003mf/Kg/日)骨骼生长和成熟降低,雌性大鼠自最低剂量(0.003mf/Kg/日)骨骼生长和成熟增加。在该剂量下雌性大鼠的骨矿密度(BMD)也降低。在同一项研究中,所有剂量的实验动物生育力均下降,并伴有脑垂体肥大、睾丸改变,包括输精管上皮退行性变和雌性大鼠生殖道萎缩。除了雌性大鼠骨骼大小及雄性大鼠睾丸的形态学改变,所有的影响均是(部分)可逆的。
来曲唑致突变作用的体外和体内研究,未显示其有任何遗传毒性作用。
在为期104周的大鼠致癌性研究中,在雄性大鼠未观察到治疗相关的肿瘤。在雌性大鼠,所有剂量来曲唑试验动物的良性和恶性乳腺肿瘤的发生率均下降。
来曲唑在胃肠道吸收迅速、完全。平均绝对生物利用度为99.9%,同时进食可轻度降低来曲唑的吸收率,但对其吸收程度(AUC)无影响。因此,来曲唑可在进食前、后或同时服用。
分布
60%的来曲唑与血浆蛋白结合,主要是白蛋白(55%)。来曲唑在红细胞中的浓度是其血浆浓度的80%。应用14C标记的来曲唑2.5 mg后,血浆中82%的放射活性物质为原形药物,因此全身的代谢产物很少。来曲唑在组织中分布迅速、广泛,稳态时的表观分布容积为1.87±0.47 L/kg。
代谢与消除
来曲唑主要的消除途径为转变为无药理活性的甲醇代谢物(清除率=2.1 L/h),接近95%的总血浆清除率,但与肝脏血流(约为90 L/h)相比这个速度相对较慢。细胞色素P450同功酶3A4和2A6可将来曲唑转化为这种代谢产物。少量未检测出的代谢物的生成,以及直接经肾脏和粪便排出的药物在来曲唑的总清除中只占很小的一部分。健康绝经后志愿者接受2周14C标记的来曲唑2.5 mg后,从尿液中回收的放射活性物质为应用剂量的88.2±7.6%,而粪便中的为3.8±0.9%。直到用药后216小时,从尿液中收集到的放射活性物质至少有75%(84.7±7.8%)为葡萄糖醛酸化的甲醇代谢物,约9%为两种未测定的代谢物,6%为原形的来曲唑。
血浆的终末半衰期为75-110小时。每日应用来曲唑2.5 mg,在2-6周内可达到稳态水平。稳态水平的血浆浓度比单次应用来曲唑的血浆浓度高近7倍,比根据单次用药推算出的稳态浓度高1.5-2倍,表明每日应用来曲唑2.5 mg的药代动力学存在轻度的非线性关系。因为治疗中能长期保持稳态水平,因此推断没有来曲唑的持续蓄积作用。
特殊临床情况的药代动力学
年龄对来曲唑的药代动力学无影响。
肾功能不全
一项涉及不同肾功能水平(24小时肌酐清除率9-116 mL/分)的志愿者的研究表明,单次应用来曲唑2.5 mg后,肾功能对其药代动力学没有影响。另外,在晚期癌症患者中,肾功能不良(计算的肌酐清除率为20-50 mL/分)对来曲唑的浓度无影响。
肝功能不全
一项涉及不同肝功能水平的研究中,有中度肝功能损害的志愿者的平均AUC比肝功能正常者高出37%,但仍在肝功能正常志愿者的范围值之内。一项对比8例肝硬化、严重肝功能不全的患者和8例健康志愿者单次应用来曲唑后的药代动力学的研究表明,前一组患者的AUC和T1/2分别升高95%和187%。因此,可以预期在有严重肝功能损害的乳腺癌患者中与没有肝损害的患者相比,来曲唑的浓度将会升高。由于在每日接受5-10 mg来曲唑的患者中没有发现毒性增加,因此在有严重肝功能不良的患者中无须调整剂量。但是,应对这些患者密切观察。
10片/盒或30片/盒。

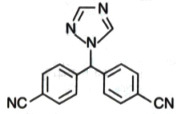 结构式
结构式







