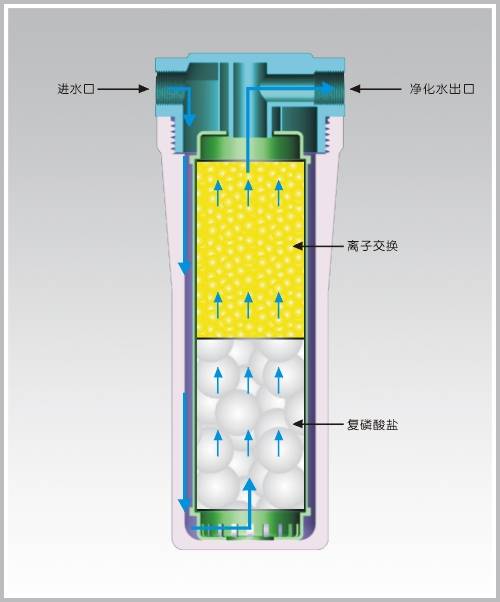
-
离子反应 编辑
电解质溶于水后,电离成为自由移动的离子。因此,电解质在溶液中的反应一定与离子有关。电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。离子反应的本质是某些离子浓度发生改变。常见离子反应多在水溶液中进行。是有离子参加的化学反应。根据反应原理,离子反应可分为复分解、盐类水解、氧化还原、络合4个类型;也可根据参加反应的微粒,分为离子间、离子与分子间、离子与原子间的反应等。极浓的电解质跟固态物质反应时,应根据反应的本质来确定是否属于离子反应。例如,浓硫酸跟铜反应时,表现的是硫酸分子的氧化性,故不属于离子反应;浓硫酸跟固体亚硫酸钠反应时,实际上是氢离子跟亚硫酸根离子间的作用,属于离子反应。此外,离子化合物在熔融状态也能发生离子反应。
复分解反应
在溶液中酸、碱、盐之间互相交换离子的反应,一般为非氧化还原反应。
这类离子反应发生的条件与复分解反应的条件一致,分三种情况:
(2)生成难电离的物质
①常见的难电离的物质
盐酸+Ca(ClO)2溶液H++ClO-=HClO
稀醋酸+苯酚钠溶液CH3COOH+C6H5O-=CH3COO-+C6H5OHNH4Cl溶液+NaOH溶液NH4++OH-=NH3·H2O
(3)生成挥发性物质
①常见的挥发性物质有:SO2、CO2、NH3、H2S等。其中SO2、CO2、NH3即是挥发性物质,也是难电离物质(H2SO3、H2CO3、NH3·H2O)进一步分解的产物,因此,从离子反应的本质上是相同的。
②有些离子反应不是电解质在电离的条件下进行的,不能用离子方程式表示。如:
的难溶物有:
离子反应
②当有关离子浓度足够大时,生成微溶物的反应也能发生,常见的微溶物有CaSO4、Ag2SO4、MgCO3、Ca(OH)2等。
如:Ca2++SO42-=CaSO4↓
 离子反应示意图
离子反应示意图
(微溶) (难溶)
CaSO4+CO32-=CaCO3↓+SO42-
(微溶) (难溶)
离子反应 实验室制HCl、HF、HNO3用浓硫酸与其盐反应:
离子反应
但Cu与浓H2SO4的反应不是离子反应。
氧化还原
 离子反应示意图
离子反应示意图
离子反应
其他的离子反应,如盐类的水解、络合反应能发生的条件是反应物的某些离子结合成难电离的物质而引起反应物离子浓度的减小。
置换反应的离子反应
 离子反应实验
离子反应实验
其它一些有离子参加的氧化还原反应
如MnO2与浓HCl反应制取Cl2;Cu与FeCl3溶液反应生成FeCl2、CuCl2;Cl2与NaOH溶液反应生成NaCl、NaClO和水等。
这些离子反应发生的条件是:比较强的氧化剂和较强的还原剂反应,生成氧化性较弱的氧化产物和还原性较弱的还原产物。因此掌握一些常见离子的氧化性或还原性的相对强弱,是判断这一类离子反应能否发生的重要依据。
离子互换
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
络合反应
例如:Ag+2NH3→
离子反应本质:反应物的某些离子浓度减少。
离子反应发生条件
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
 离子反应实验
离子反应实验
(1)非氧化还原型的离子反应条件:
a.离子交换型:
例如:Ag﹢+ Cl﹣= AgCl↓
离子交换后要有沉淀、气体、弱电解质三者之一生成才能发生反应。
b.双水解反应型:
例如:2Al 3+;﹢+ 3CO32﹣ + 3H2O = 2Al(OH)3↓ + 3CO2↑
要生成更难溶解的物质或弱电解质才能发生离子反应。
c.络合反应型:
例如:Ag﹢+2NH3 →
生成比简单离子更稳定的络离子,离子反应才能进行。
(2)氧化还原型离子反应条件:
 离子反应条件
离子反应条件
∵氧化性 还原性
∴此反应才能进行。
难点:离子在溶液中大量共存的规律。
即:向溶液中有关离子浓度减小的方向进行
判断原则:在溶液中所有离子之间不能发生任何类型的反应,否则离子不能共存。
例如:生成沉淀的:如Ba2﹢与SO42﹣,CO32﹣;Ag+与Cl﹣,SO42﹣
(生成难电离的物质:H﹢与OH﹣;CH3COO-与H﹢;NH4﹢与OH﹣;H﹢与F﹣)
(生成气体(挥发性物质)如:H+与CO32﹣,S2﹣,SO32﹣)
发生氧化还原: (H﹢)KMnO4与I﹣,S2﹣;Fe2﹢与Fe3﹢
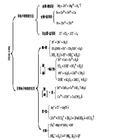 离子反应结构
离子反应结构
强氧化性离子:MnO4﹣ 、Cr2O7 - 、 ClO﹣、 Fe2﹢、 (H﹢)NO3﹣
强还原性离子:S2﹣、 I﹣、 Fe 、HS-、 Sn 、S2O3 2-、SO32﹣ 、HSO3﹣
因发生氧化还原反应无法大量共存
离子反应中,不可以拆开的物质有:单质、气体、沉淀、水、弱酸、弱碱、氧化物及绝大部分有机物(有机盐除外)
常见有色离子:Fe3+:棕黄色 Fe2+:浅绿色 Cu2+:蓝色 MnO4-:紫色……
1.由于发生复分解反应,离子不能大量共存
(1)有气体产生。例如:CO32-、SO32-、S、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。例如:Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与Cl-、Br-、I-等不能大量共存。
(3)有弱电解质生成。例如:OH﹣、CH3COO﹣、PO43﹣、HPO42﹣、H2PO4﹣、F-、ClO﹣、AlO2-、SiO32﹣、CN-、C17H35COO-等与H﹢不能大量共存;一些酸式弱酸根,例如:HCO3﹣、HPO42﹣、HS-、H2PO4﹣、HSO3-不能与OH﹣大量共存;NH4+与OH-不能大量共存。
 离子反应器
离子反应器
① 例如:AlO2-、S2﹣、CO32﹣、C6H5O-等必须在碱性条件下才能在溶液中存在;
②再如:Fe2﹢、Al3﹢等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。例如:3AlO2﹣十Al3﹢十6H2O=4Al(OH)3↓等
典型双水解的条件;弱酸根、弱碱根离子对应的酸碱容易从体系中脱离。即生成沉淀、气体或同时生成两种沉淀

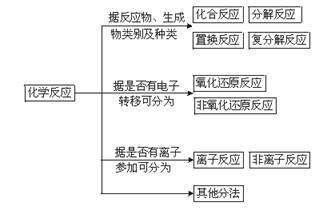
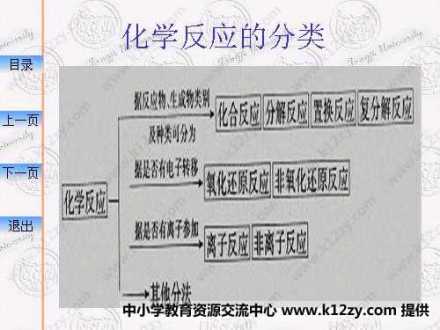 化学反应分类
化学反应分类