-
人造血液 编辑
人造血液,又称氟化碳乳剂人工血液,英文名Artificial blood;人造血液是一类具有载氧能力,可暂时替代血液部分功能的液体制剂。主要用于外伤、医疗手术等所致大出血的治疗,近年来开始用于遗体器官的保存、一氧化碳中毒的治疗,以及体外循环预充液和心肌保护的研究。2013年罗马尼亚科学家研制出一种人造血液—由水、无机盐以及一种深海昆虫体内提取的蚯蚓血红蛋白合成的材料,可短时间替代血液实现氧气和二氧化碳交换代谢。同年12月,日本研究人员成功利用干细胞培育出能够携带氧的红细胞,在此基础上可以大量培育用于输血的红细胞,帮助医疗系统缓解用血紧张状况。
中文名:人造血液
外文名:Artificial blood
中文全称:氟化碳乳剂人工血液
功能:暂时替代血液部分功能的液体制剂
适用:用于外伤、手术等所致大出血治疗
缺点:不能输送养分,无凝血功能等
近来用于:保存离体器官和一氧化碳中毒治疗
研究用于:体外循环预充液和心肌保护
血液
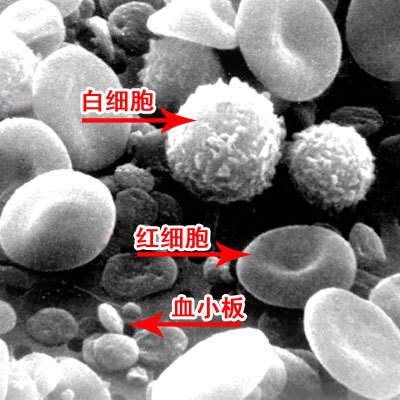
血液的组成有机而复杂。为了维持体内的生化环境稳定,人体的造血过程是相对缓慢的。因此在面对如外伤、外科手术等突如其来的血液需求时,往往需要从外部输血。而传统的血液来源依赖公民献血和转基因动物 ,不仅供血量不稳定,而且面临各种风险:血源中的HIV病毒、肝炎病毒等存在着传染的可能;心脏搭桥手术的输血过程中一旦出现小气泡,将危及患者的健康;在患者需要高氧治疗时,普通血液的携氧能力又不尽如人意。人造血液正是在这些问题的推动下应运而生。随着医学技术的发展,人造血液会越来越完整地实现自然血液的生理功能,相应地,血库告急、配型不符之类的问题也有希望随之迎刃而解。 血液嫁接
血液嫁接
1979年,一种新型的氟碳化合物乳剂作为人造血液,首次在日本应用于人体单肾脏移植手术,并取得成功。时隔不久,美国也报道了人造血液给一位信仰宗教、拒绝输血的老人治疗血液病获得成功。这种奇妙的人造血液,是白色的;不分血型, 不管哪种血型的人都能使用,所以我们说人造血液是名符其实的万能血液。
1980年8月6日,中国人造血液的研究在上海获得成功。这是中国科学院上海有机化学研究所和中国人民解放军第三军医大学的科学工作者经过5年的研究而试制成功的。人造血液是氟碳化合物在水中的超细乳状液。这种奇妙的白色血液注入人体后,同人体正常血中的红细胞一样,具有良好的载氧能力和排出二氧化碳的能力,可以说,它是一种红细胞的代用品。氟碳化合物像螃蟹的螯那样,能够把氧抓住,在人体里再把氧气放出来,进行人体里的特种氧化还原反应。它的生物化学性质十分稳定,不管哪种血型的人,都能使用人造血液。
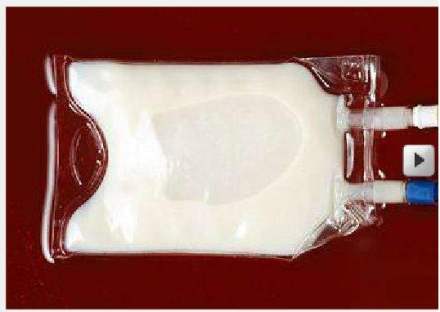
中国人造血液研制成果
库珀教授是欧洲血液代用品工程中的成员,这个组织成立于两年前,专门研究人造血液。这项工程的研究人员分别来自英国、丹麦、法国、荷兰、意大利、瑞典和匈牙利,他们集中精力研究血红蛋白替代品。美国比普勒公司已经研发出一种叫作“Hemopure”的新产品,并且在世界艾滋病感染率很高的南非投入使用,只是还没被获准在美洲和欧洲使用。“Hemopure”使用了从牛血中提取的血红蛋白,考虑到牛海绵状脑病感染因素,这种新产品更难被美国和欧洲接受。血红蛋白可从过期的捐献血液、牛的血液甚至植物和真菌中提取。然后对它进行改良,确保注入体内后它能保持稳定。因为血红蛋白不包括能让血液形成不同类型的分子,因此,相同的血红蛋白代替品可以应用到不同病人身上。而且它可以被放在室温下永久保存,运输也很方便。当欧洲研究员还把目光聚焦在以血红蛋白为基础的产品上时,美国已经转向了另一人造血液来源———一种被称作六氟化硫的聚四氟乙烯类型的人工合成液体上。六氟化硫可消溶大量氧气,造价便宜,易于制作,并且储藏简单。但在操作过程中,病人需要通过特定面具吸入70%-100%的氧气,这就意味着在医院以外的环境下使用这种物质的可能受到限制。
 英国研制人造血液
英国研制人造血液
2013年,罗马尼亚科学家研制出一种人造血液—由水、无机盐以及一种深海昆虫体内提取的蚯蚓血红蛋白合成的材料,可短时间替代血液实现氧气和二氧化碳交换代谢。这一成果如果得以成功推广应用,则有望缓解血库的供给短缺,甚至避免血液污染的风险,同时通过化学修饰,实现对气体的高溶解度,避免气泡的产生,大大提高输血的适用范围和临床功效。
2013年12月,日本研究人员成功利用干细胞培育出能够携带氧的红细胞,在此基础上有望大量培育用于输血的红细胞,帮助医疗系统缓解用血紧张状况。
研究发现虽然成熟的红细胞不能自我复制,但其发育过程中的“半成品”——红系祖细胞具有复制能力,他们发现有两个基因对红系祖细胞的复制和成熟发挥重要作用。将这两个基因导入诱导性多能干细胞和胚胎干细胞中后,成功培育出在实验室中几乎可以无限复制增殖的红系祖细胞,并使它们成功分化为成熟的红细胞。分化出的红细胞中大部分都是胚胎血红蛋白,与成人血红蛋白不同,但研究人员证实这些血红蛋白有携氧能力,并能在输血后在实验鼠体内循环。
(1)人工合成的血红蛋白;
(2)用天然血红蛋白制成的人工红血球;
(3)人工合成具有携氧功能的氟碳化合物。氟碳代血液是由全氟化合物组成的胶体超微乳剂,具有良好的携氧能力,在一定浓度和氧分压条件下,其氧溶解度为水的20倍,比血液高2倍。作为人工血应用较好的氟碳化合物有全氟正丁基呋喃、全氟三丁胺、氟列昂E4、全氟萘烷、全氟甲基萘烷,全氟三丙胺等。
人们发现了两大类血液替代品——血红蛋白携氧载体(HBC)和全氟碳化物(PFC)。已经有部分人工血液接近测试阶段的尾声,很快便可在医院应用。另有一些则已经开始应用。例如,被称为牛血红蛋白多聚体(Hemopure)的HBOC类血液替代品正应用于受HIV威胁严重的南非。而在欧美,一种名为Oxygent的PFC类携氧载体已进入人体试验的后期阶段。
这两类血液替代品化学结构迥异,但基本都是通过被动扩散来实现功能。被动扩散利用了气体趋向于从高浓度区域移至低浓度区域,直至达到平衡状态的属性。在人体内,氧气从肺(高浓度)移至血液(低浓度)中;随后,一旦血液到达毛细血管,氧气即从血液(高浓度)移至组织(低浓度)。
HBOC
HBOC与血液大致类似。它们呈暗红色或紫红色,由经灭菌处理的血红蛋白制成,血红蛋白的来源有很多:
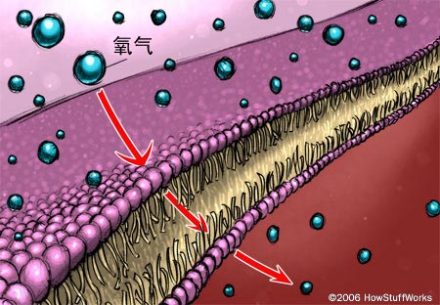 人工血液利用了被动扩散的原理
人工血液利用了被动扩散的原理
2、来自牛血的红细胞
3、可产生血红蛋白的转基因细菌
4、人类胎盘
但是,医生不能直接将血红蛋白注射到人体中。当血红蛋白进入血细胞后,完全可以起到携带和释放氧气的功能。但如果没有细胞膜的保护,血红蛋白的分解速度会非常快,可能会导致肾脏严重损伤。
出于该原因,大多数HBC使用的是比天然分子坚固得多的改进型血红蛋白。一些最常见的技术是:
1、将血红蛋白分子与名为双阿司匹林的携氧血红蛋白衍生物进行部分交联
2、过多分子彼此结合,形成聚合血红蛋白
3、将其与聚合物结合,形成共轭血红蛋白
科学家还研究了由类脂物、胆固醇或脂肪酸制成的人造膜包裹血红蛋白的HBOC。有一种名叫MP4的HBOC就是由聚乙二醇包覆的血红蛋白制成的。
HBOC的工作方式与普通红细胞大致相同。HBOC分子漂浮在血浆中,从肺中获得氧气并将其释放到毛细血管中。这些分子比红细胞小得多,因此可以到达红细胞无法流经的地方,如极端肿胀的组织或恶性肿瘤周围的异常血管等。大多数HBOC在人体血液中停留一天左右——比普通红细胞100天的循环周期短得多。
但是,HBOC也有一些副作用。改进型血红蛋白分子可进入细胞间的微小空间并结合一氧化氮,一氧化氮对于维持血压非常重要。这会导致病人的血压飙升。HBOC还可导致腹部不适和绞痛,这很可能是由于自由基的释放,而自由基是一种对细胞有害的分子。某些HBOC还会导致眼睛暂时变红或皮肤潮红。
PFC
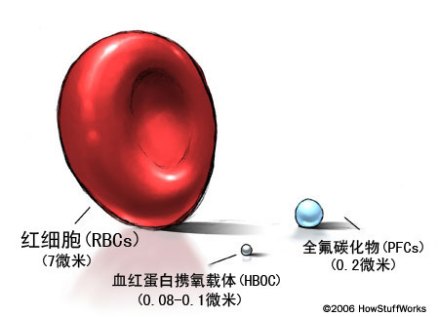 HBOC和PFC均比红细胞小得多
HBOC和PFC均比红细胞小得多
PFC具有化学惰性,但在携带溶解气体方面很出色。它们能够比水或血浆多携带20%至30%的气体,如果存在更多的气体,它们还能携带得更多。出于该原因,
医生在使用PFC的同时会进行输氧。但是,多余的氧气可导致人体内自由基的释放。研究人员正在研究PFC能否在没有额外氧气的条件下工作。
PFC既油又滑,因此在使用时必须先进行乳化处理或悬浮在某种溶液中。PFC一般与通常用于静脉注射的其他药物混合使用,如卵磷脂或白蛋白。这些乳化剂最终会在离开血液循环系统时分解,肝脏和肾脏将其从血液中除去,肺会像呼出二氧化碳一样,将PFC呼出体外。有时,在机体分解和呼出PFC时,人体会产生类似流感的症状。
与HBOC类似,PFC体积很小,可以到达红细胞无法到达的地方。出于该原因,有些医院研究了是否可以使用PFC将氧气送过肿胀的脑组织,以此治疗创伤性脑损伤(TBI)。
制药公司正在测试PFC和HBOC在某些特定医疗情况下的疗效,但它们还有很多潜在用途,例如:
1、在创伤失血后,恢复人体供氧能力,特别是在急救室和战场上
2、预防在手术过程中突然急需输血
3、维持通向肿瘤组织的氧流量,以使化疗更为有效
4、治疗会导致红细胞数量减少的贫血病
5、向受到镰刀状细胞贫血症影响的身体肿胀组织输送氧气
另一种思路是模拟人体血液中血红蛋白的携氧机制,罗马尼亚科学家拉杜教授设计出的人造血液采用的便是这种设计思路。这类人造血液有着较好的生理相容性,输血后产生的排异反应和免疫反应较小。以往的人造血液由于缺少自然血液中所必需的生化组分,其血氧解离曲线(一种描述携氧能力的关系图)与正常生理情况不一致。
人造血红蛋白在无细胞的环境下,化学性质很不稳定,对血液渗透压影响也较大,且有一定的肾毒性,而拉杜教授的最新研究成果,既可以很好地模拟生理环境下的血液携氧机制,又能保持一定的化学稳定性,从而降低了肾毒性和对血压的扰动。这种人造血液的最新动物全血置换实验已取得了较好的结果,有望用于临床试验。
碳氟化物
碳氟化物(PFC)的化学结构类似铁氟龙(聚四氟乙烯),主要是由碳原子与氟原子所组成。在我们日常生活中,炒菜锅的内面常镀上一层铁氟龙,主要是因为铁氟龙化性相当稳定,且由于它的表面能很低,可以防止煎鱼或煎蛋时易沾锅的现象。碳氟化物不但化学性质稳定,在生物体内也相当安定,在做成人工替代血液的过程中以及高温灭菌与后续的产品保存期间也都相当稳定。
对于氧气来说,碳氟化物是一个相当好的溶剂,可以自肺里携带氧气至人体内的各部分组织与器官,让细胞进行新陈代谢。在执行完它的输氧功能之后,碳氟化物又可经由呼吸作用自肺排出,或经由排汗的过程由皮肤表面排出。
假如我们将一只老鼠放在盛有碳氟化物溶液的烧杯里,老鼠并不会如我们被淹死,主要的原因是可以溶解大量的氧气。由于碳氟化物不溶于水,所以通常是以乳化的方法将其制成大约200纳米大小的颗粒分散液,再以点滴的方式注入病人的静脉里。与人体红血球的尺寸(1~8微米)相比,经乳化后的碳氟化物纳米颗粒相当小,其携带氧气的面积可以大幅提高,且可以穿过红血球无法通过的阻塞血管,达到实时救命的目的。碳氟化物仍在临床试验的阶段。
经化学修饰的血红素
血红素的分子量约为64,50DAlton,主要存在于红血球中,由四个胜肽链所组成,分别为二个α链与二个β链,每一个α链由14个氨基酸所组成,而β链则为146个氨基酸所组成。每条α链及β链上皆有一个原血红素基与之相连,其中的亚铁离子(Fe2+)可以利用配位键的方式与一个氧分子结合,能够可逆地行使携氧与释氧的功能,因此每一个血红素分子最多可以携带四个氧分子。
在人体内,当红血球行经肺脏时,由于肺泡里的氧分压高达100毫米汞柱(mmHg),使得红血球里的每一血红素分子可以充分地携带氧气。当携氧的红血球行经人体的各部分组织或器官时,由于氧分压降至约40毫米汞柱,红血球里的血红素分子便将其所携带的氧分子释放出来,以参与附近细胞的新陈代谢作用。血红素与氧分子的亲和力,与红血球内的一重要分子(2,3-DPG)有相当密切的关系。
经由纯化过程所取得的血红素溶液,由于红血球被打破,造成2,3-DPG分子的流失,导致血红素对氧的亲和力过高,而降低了其在人体组织或器官中的释氧功能。因此若以血红素为基质来制备人工替代血液,必须对纯化出来的血红素溶液做适当的物理或化学修饰,以符合人体的生理要求。当前以血红素为基材发展的人工替代血液,大致可分为包覆型人工替代血液、基因重组型人工替代血液与聚合型人工替代血液等。
a,包覆型人工替代血液:以磷脂质经由乳化技术将血红素包覆起来,形成直径约100~200奈米大小的颗粒,如此可以避免血红素在体内被快速分解掉,增加其在人体血液循环中的半衰期,且在人体胶体渗透压的限制下,可以有正常的血红素浓度。在包覆过程中同时也把2,3-DPG分子包覆在磷脂质里面,以调控血红素分子对氧分子的亲和力。
b,基因重组型人工替代血液:主要是利用基因技术,将血红素的α或β链的基因转殖到大肠杆菌里面,由大肠杆菌来表现,制造出血红素分子。利用基因技术可以改变α或β链上某些特定的氨基酸,例如将β链上第108个氨基酸,由原来的天门冬胺酸改变成离胺酸,可以使得血红素对氧的亲和力降低。
c,聚合型人工替代血液:又可分为分子内部交联型血红素、分子与分子间交联型血红素与共轭交联型血红素。
1.分子内部交联型血红素:血红素分子内部的交联可以用PLP(pyridoxyl 5'-phosphate)分子代替2,3-DPG分子,做为修饰血红素对氧分子亲和力的交联剂。由于PLP和2,3-DPG对脱氧状态的血红素分子结合的位置相同,因此可以稳定其去氧结构,使血红素对氧的亲和力降低。这样的分子内部交联也同时稳定了血红素的四聚体结构,避免在人体血液循环过程中被快速分解掉,因此可以改善血红素分子在人体内滞留的半衰期。
2.分子与分子间交联型血红素:分子内部交联后的血红素分子,若进一步以另一交联剂将血红素分子与分子间交联起来,则可以有效地增加其在人体血液循环中的半衰期达六至七倍。较常用的交联剂为戊二醛。
聚合血红素最重要的就是控制其分子量分布及适当的携氧能力,较适当的分子量大小约在20万~40万dalton,以不超过50万dalton为佳,也就是相当于二至八个血红素分子聚合的大小。若聚合程度过高,则聚合后的血红素溶液黏度会过大,导致血液流变性质的改变。若血红素分子聚合程度过低,则无法得到适当的携氧能力以及在人体内的适当半衰期。
然而戊二醛与血红素分子进行的聚合反应很快,所制造出来的聚合血红素分子量分布往往相当广,容易造成许多过聚合的高分子聚合物。此外,戊二醛聚合血红素无法在储存及加热过程中维持稳定结构,容易释放出对人体有害的戊二醛分子,因此戊二醛并非制造聚合血红素最佳的交联剂。
3.共轭交联型血红素:利用交联剂将血红素分子以共价键结的方式键结在水溶性高分子链上,目的除了增加血红素分子的体积以减缓血红素分子由肾丝球体漏出外,亦可避免血液中其它蛋白质的吸附,以降低人体免疫系统的攻击。
英国国民保健制度网站发布消息,已经有两名志愿者接受“人造红细胞”输血,输入量在5至10毫升之间,两名志愿者均未出现任何副作用。此外,后续还将有至少8名志愿者参与这项试验。所有志愿者将间隔至少4个月接受两次少量红细胞输入:一次为人造红细胞,另外一次为普通红细胞。
优点
世界各地的医院每年需要大量血液,但全世界每年捐献的血液远远无法满足这一需求。而经过研究试验表明,“人造血”具有高气溶性,在血管内可起到携带氧气和排除二氧化碳的作用。它有以下几个特点:
一是不受血型限制,可用于各种血型的人,输血后不会发生严重的溶血反应,特别是在抢救情况下,时间就是生命,可以不查血型,不做交叉配血试验而马上使用,对大规模的现场急救,更是简便、快速;
二是容易保存,不必像献血者的鲜血那样要贮存在4℃一6℃的冰箱内,人造血可保存数年之久;
三是不会发生交叉感染。通常输血如果检查不严,会将一些细菌、病毒带入受血者体内,发生交叉感染,而人造血液是工业生产制造的,不会有细菌或病毒的混入。
缺点
人造血液与人体内的血液相比,还有许多缺点,它不能输送养分,也没有凝固血液的本领,更没有对外界感染至关重要的免疫能力。因此要研究出像人的血液那样的代用品,还要经过很大的努力。
有些产品已处在临床试验的最后阶段,但在人类身上进行试验时,有些病人出现像流感一样的征状。不像真的红色原料,血红蛋白和六氟化硫都只能在血流条件下,在几天内起作用,因此它们只在短期内有帮助。然而,它们确实在减少传染病的传播途径和为拒绝输血的宗教徒提供新的选择方面有很大潜力。
陈勤奋认为,一旦相关技术成熟,人造血可以通过标准的流水线生产。对若干年后的病人来说,可能输一次血就跟吃一粒药一样稀松平常——因为都是流水线加工的标准产品。
不过也有伦理学界对此持更谨慎态度。从人工DNA到人工合成细胞再到人工制造血液,合成生物学屡屡有振聋发聩的新突破,但正如英国《观察家报》的评价所言,“这是21世纪最为大胆、最有争议、也最具科学性的领域”。据悉,英国皇家学会已经开始就合成生物技术向公众征集意见,考虑出台相关的监管条例。
此外,也有专家认为,合成生物学很可能会消解人类对于自然的最后一点敬畏之心。当身上流的血液都是人工造的,人们在感慨技术强大的同时,是不是再也不会对生命充满感激和尊重?