-
PCR扩增仪 编辑
PCR扩增仪又称为PCR基因扩增仪、PCR核酸扩增仪、聚合酶链反应核酸扩增仪,是利用PCR(Polymerase chain reaCTion,聚合酶链反应)技术对特定DNA扩增的一种仪器设备,被广泛运用于医学、生物学实验室中,例如用于判断检体中是否会表现某遗传疾病的图谱、传染病的诊断、基因复制以及亲子鉴定等。
1985年,美国PE-Cetus公司的Kary Mullis等人发明PCR技术。它推动了现代医学由细胞水平向分子水平、基因水平发展,是DNA测序的基础,它成为现代分子生物学发展过程中的一座里程碑。Mullis等也因此获得了1993年的诺贝尔奖。
1. 模板DNA的变性
模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备。
2. 模板DNA与引物的退火(复性)
模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链互补序列配对结合。
3. 引物的延伸
DNA模板-引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA链互补的半保留复制链。
重复循环变性-退火-延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一轮循环需2~4分钟,如此反复进行,每一轮循环所产生的DNA均能成为下一轮循环的模板,每一轮循环都使两条人工合成的引物间的DNA特异区拷贝数扩增1倍,PCR产物以2的指数形式迅速扩增,经过25~30轮循环后(2~3小时),理论上可使基因扩增109倍以上,实际上一般可达106~107倍。
1. 模板核酸
模板(靶基因或样品DNA)核酸的量与纯化程度是PCR成败与否的关键环节之一。一般临床检测标本,可采用快速简便的方法溶解细胞,裂解病原体,消化除去染色体的蛋白质使靶基因游离,直接用于PCR扩增。DNA模板提取一般采用异硫氰酸胍或蛋白酶K法,要防止核糖核酸酶(ribonuclease,RNase)降解RNA。
2. 引物
PCR产物的特异性取决于引物与模板DNA互补的程度。理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链作引物。每条引物链的浓度为0.1~1μmol或10-100pmol,以反应所需要的最低引物量的浓度为好。
3. DNA聚合酶
TaqDNA聚合酶基因全长2496个碱基,75~80℃时每个酶分子每秒钟可延伸约150个核苷酸,在PCR循环的高温条件下仍能保持较高的活性和良好的热稳定性,温度过高(90℃以上)或过低(22℃)都可影响TaqDNA聚合酶的活性。目前,有两种TaqDNA聚合酶供应,一种是从栖热水生杆菌中提纯的天然酶,另一种为大肠菌合成的基因工程酶。
4. 三磷酸脱氧核苷酸(dNTP)
dNTP的质量与浓度和PCR扩增效率有密切关系。在PCR反应中,dNTP应为50-200μmol/L,尤其是注意4种dNTP的浓度要相等(等摩尔配制),浓度过低又会降低PCR产物的产量。
5. 镁离子浓度
Mg2+能与dNTP结合,Mg2+对PCR扩增的特异性和产量有显著的影响。在一般的PCR反应中,各种dNTP浓度为20μmol/L时,Mg2+浓度为1.5~2.0mmol/L为宜,Mg2+浓度过高,反应特异性降低,出现非特异扩增:浓度过低,会降低taqDNA聚合酶的活性,使反应产物减少。
1. 温度与时间的设置:基于PCR原理三步骤而设置变性-退火-延伸3个温度点。在标准反应中,双链DNA在90~95℃变性,再迅速冷却至40~60℃,引物退火并结合到靶序列上,然后快速升温至70~75℃,在 TaqDNA聚合酶的作用下,使引物链沿模板延伸。
2. PCR反应时间:变性时间一般2~3min,可以使模板DNA完全变性。复性时间一般为30~60s,足以使引物与模板之间完全结合。PCR延伸反应的时间可根据待扩增片段的长度而定,一般1kb以内的DNA片段,延伸时间1min是足够的。
3. 循环次数:循环次数决定PCR扩增程度。PCR循环次数主要取决于模板DNA的浓度。一般的循环次数选在30-40次之间,循环次数越多,非特异性产物的量亦随之增多
1. 普通PCR仪
一次PCR扩增只能运行一个特定退火温度的PCR仪称作传统PCR仪,也叫普通PCR仪。如果要做不同的退火温度需要多次运行。主要是用于简单的、对目的基因退火温度的扩增。该仪器主要应用于科学研究、教学、医学临床、检验检疫等机构。
2. 梯度PCR仪
一次性PCR扩增可以设置一系列不同的退火温度条件(温度梯度,通常有12种温度梯度)的PCR仪称作梯度PCR仪。因为被扩增的不同DNA片段,其最适退火温度是不同的,通过设置一系列的梯度退火温度进行扩增,从而一次性PCR扩增,就可以筛选出表达量高的最适退火温度,进行有效的扩增。用于研究未知DNA退火温度的扩增,这样节约成本的同时也节约了时间。梯度PCR仪在不设置梯度的情况下也可以做普通PCR扩增。主要应用于科研、教学机构。
3. 原位PCR仪
用于从细胞内靶DNA的定位分析的细胞内基因扩增仪称作原位PCR仪。如病源基因在细胞的位置或目的基因在细胞内的作用位置等。是保持细胞或组织的完整性,使PCR反应体系渗透到组织和细胞中,在细胞的靶DNA所在位置上进行基因扩增。不但可以检测到靶DNA,又能标出靶序列在细胞内的位置,对于在分子和细胞水平上研究疾病的发病机理和临床过程及病理的转变有重大的实用价值。主要应用于临床、科研。
4. 实时荧光定量PCR仪
在普通PCR仪的基础上增加一个荧光信号采集系统和计算机分析处理系统的PCR仪称作荧光定量PCR仪。其PCR扩增原理和普通PCR仪扩增原理相同,只是PCR扩增时加入的引物是利用同位素、荧光素等进行标记,使用引物和荧光探针同时与模板特异性结合扩增。扩增的结果通过荧光信号采集系统实时采集信号连接输送到计算机分析处理系统得出量化的实时结果输出。把这种PCR仪叫做实时荧光定量PCR仪(qPCR仪)。荧光定量PCR仪有单通道、双通道和多通道。当只用一种荧光探针标记的时候,选用单通道,有多荧光标记的时候用多通道。单通道也可以检测多荧光的标记的目的基因表达产物,因为一次只能检测一种目的基因的扩增量,需多次扩增才能检测完不同目的基因片段的量。主要用于医学临床检测、生物医药研发、食品行业、科研院校等机构。
根据DNA扩增时升温介质的不同可以将PCR仪分为:变温铝块式PCR仪、水浴式PCR仪和变温式流式PCR仪。
1. 变温铝块式PCR仪
热源用电阻丝、导电热膜、热泵式珀尔帖半导体元件制作,让带有凹孔的铝块升温,用自来水、制冷压缩机或半导体降温。优点:温度传导快,各管的扩增一致性好;反应管规格一致时无须外涂石蜡油;可用微电脑调节温度转换;仪器制冷部件可以在完成扩增后降温至4℃,保存样品过夜。缺点:管内反应液温度比铝块显示温度滞后;须使用特制且与铝块凹孔形状紧密吻合的薄壁耐热反应管;变温时难以快速克服铝块的热容量;压缩机制冷启动慢、重量大、滞后时间长。
2. 水浴式PCR仪
仪器本身有3个不同温度的水浴,用机械装置将带有反应管的架子移位和升降温度,使温度循环。优点:水为传热介质,温度易恒定,热容量大;反应管形状无特殊要求,温度转换较快扩增效果稳定;具有较高的运行效率,扩增产物特异性好。缺点:高温浴不稳定,水面需用液体石蜡覆盖;改变水浴温度所需时间较长,不易实施复杂程序(如套式PCR)的操作,仪器体积较大;室温影响温度下限。
3. 变温式流式PCR仪
依据空气流的动力学原理,以冷热气流为介质升降温度。优点:变温迅速,扩增效果好,适合于微量、快速PCR;反应器不受形状限制,管外无需涂液体石蜡;测定管内液体温度作为控温依据,显示温度真实可靠;易于用微电脑设定复杂的变温程序;易于制成重量较轻的便携式仪器,适合外出作业。缺点:以室温为温度下限,低温难控制,对空气流的动力学要求较高,需精心设计才能使各管温度均匀。
感染性疾病的诊断:PCR技术在感染性疾病中尤其适用于检测一些培养周期长或缺乏稳定可靠检测手段的病原体。
2.遗传性疾病的诊断:遗传性疾病的发病基础是核酸分子结构变异与核酸的表达产物,如蛋白质或酶类分子结构的改变。PCR技术的原理恰好为检测这一类疾病提供了有效的手段。
3.恶性肿瘤的诊断:PCR技术用于癌基因和抑癌基因缺失与点突变的检测以及肿瘤相关病毒基因的检测,为临床诊断带来了简便快速、准确的方法,同时也为肿瘤相关疾病的治疗与预后提供了监控手段。
4.移植配型:随着PCR技术的出现,分子生物学技术被引入到HLA配型领域,通过PCR扩增仪可以建立快速、准确的HLA基因分型方法,满足临床移植配型的需要。

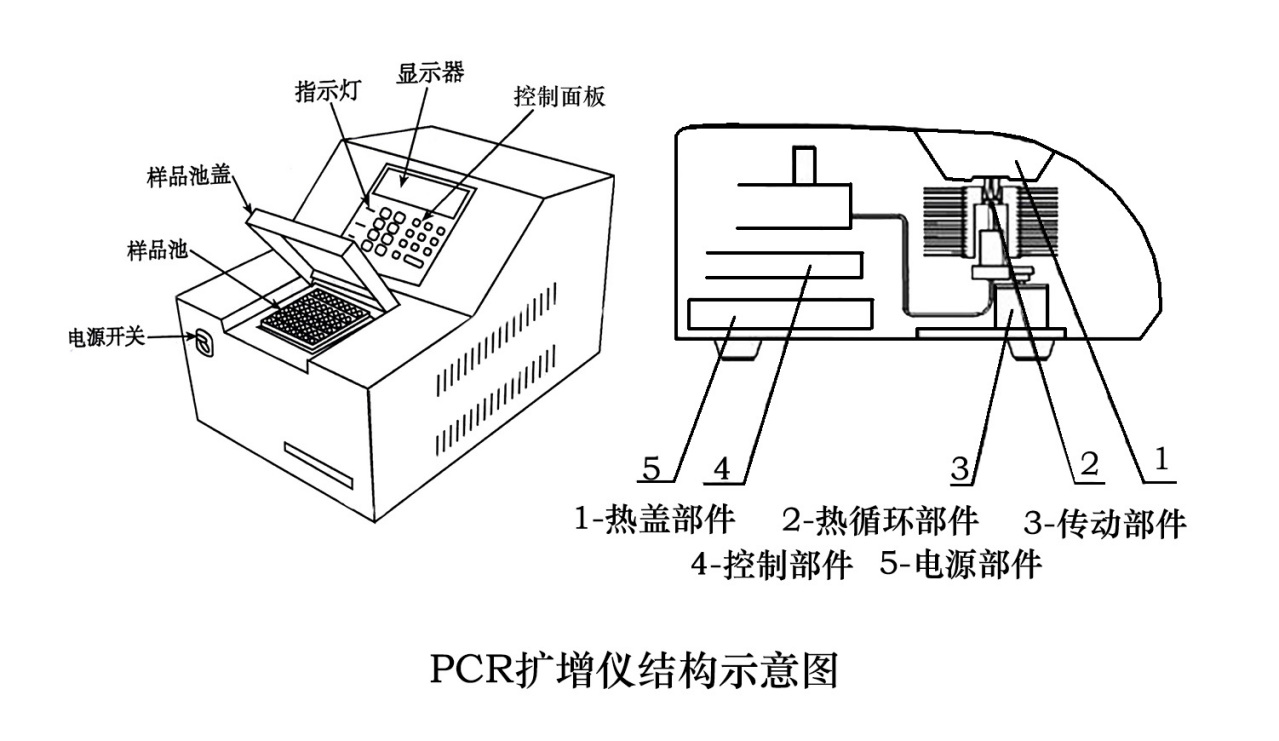 PCR扩增仪结构示意图
PCR扩增仪结构示意图








