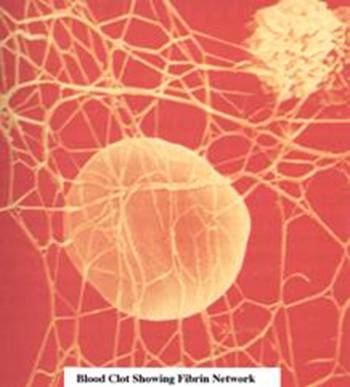
-
凝血酶原 编辑
血液凝固因子之一。存在于血浆中,亦称第Ⅱ因子。是凝血酶的前身物质,血浆中含量为10—15毫克/分升,分子量为68000的糖蛋白。糖的含量约占11%,其中含有半乳糖、甘露糖、岩藻糖、氨基已糖、唾液酸。遗传性凝血酶原(凝血因子Ⅱ)缺乏是最为罕见的遗传性出血病之一可以将凝血酶原缺乏分成两类:①低凝血酶原血症(Ⅰ型缺乏),以抗原和活性同时降低为特点;②异常凝血酶原血症(Ⅱ型缺乏),特点是抗原水平正常或正常低限凝血酶原活性减低。
中文名:凝血酶原
外文名:prothrombin, F Ⅱ
存在于:血浆中
概念:凝血酶的前身
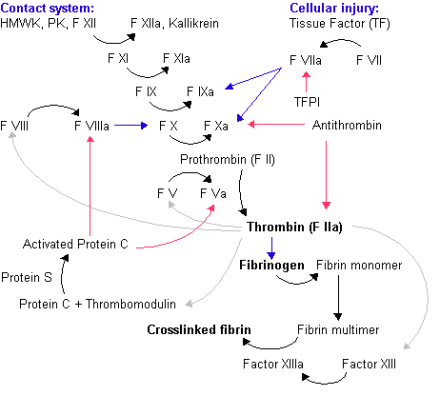 凝血酶原
凝血酶原
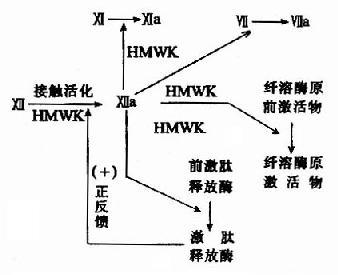 凝血酶原
凝血酶原
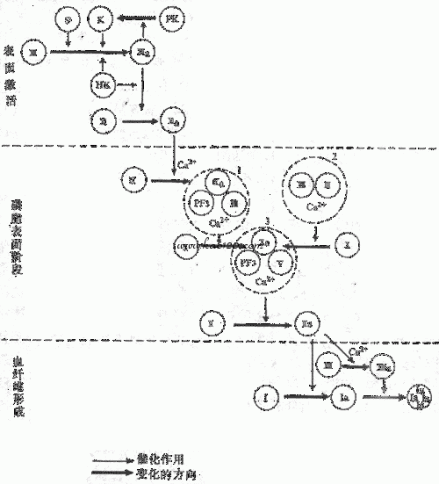 凝血酶原
凝血酶原
当急性肝炎时,凝血酶原的活动度降低幅度并不明显。如果是重症乙肝患者,或者是肝硬化、慢性乙肝患者,在做凝血酶原的活动度检测时,就会发现凝血酶原的活动度会明显降低,则就表明病情急剧加重,肝细胞受到了严重的损伤。判断依据是:凝血酶原的活动度小于40%,为肝细胞坏死的肯定界限。
凝血酶原基因位于第11号染色体,基因长21kb,有14个外显子和13个内含子,其mRNA为2kb.合成622个氨基酸的肽链,其中前导肽43个氨基酸,在分泌过程中裂解。虽然正常凝血酶原的核苷酸顺序和氨基酸顺序已经阐明,但其基因变异的研究没有FⅧ和FⅨ深入。凝血酶原异常有钙离子联结部位的缺陷,FⅩa裂解的缺陷和生成凝血酶活性的缺陷。与FⅧ和FⅨ相似,发生在CpG二核苷酸序列的突变更多见,单个氨基酸的取代可以发生在影响被FⅩa裂解的部位,酶活性的部位以及钙联结部位。
凝血酶原时间测定的意义总的来说是反映肝脏合成功能、储备功能、病变严重程度及预后。根据其正常值是偏高还是偏低可以大致的判断出疾病种类。
凝血酶原时间测定的意义一:诊断肝病的严重程度。肝脏是凝血因子形成的主要场所,当肝功受损时凝血因子不能正常合成,导致凝血酶原时间偏高延长。