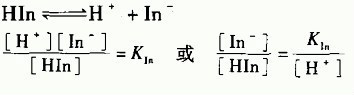-
电离平衡常数 编辑
中文名:电离平衡常数
性质:名词
类别:学术
符号:Ka(弱酸);Kb(弱碱)
电离常数是电离平衡的平衡常数,描述了一定温度下,弱电解质的电离能力。
弱电解质在一定条件下电离达到平衡时,(水)溶液中电离所生成的各种离子浓度以其在化学方程式中的计量数为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量数为幂的乘积的比值,即溶液中电离出来的各离子浓度乘积
要注意的是电离平衡常数只适用于弱电解质的计算,强电解质不适用*。
*注:但这并不是说强电解质没有电离平衡常数,由于物理作用等因素影响,强电解质也并非完全电离。只不过强电解质不使用电离平衡常数进行相关计算。强电解质可以用阴阳离子平均活度(由于单个离子活度无法确定,阴阳离子平均活度可以由实验测定 )来表示电离程度,参与计算。
具有极性共价键的弱电解质(例如部分弱酸、弱碱)溶于水时,其分子可以微弱电离出离子;同时,溶液中的相应离子也可以结合成分子。一般地,自上述反应开始起,弱电解质分子电离出离子的速率不断降低,而离子重新结合成弱电解质分子的速率不断升高,当两者的反应速率相等时,溶液便达到了电离平衡。此时,溶液中电解质分子的浓度与离子的浓度分别处于稳定状态,不再发生变化。
用简单的语言概括电离平衡的定义,即:在一定条件下,弱电解质的离子化速率等于其分子化速率。
在上述反应过程中,弱电解质分子电离与离子结合成为分子,二者共同构成一组可逆反应。常以弱电解质分子电离出离子的反应方向为正反应方向,以离子重新结合成弱电解质分子的反应方向为逆反应方向。
与化学平衡一样,电离平衡是可以因为条件变化(如浓度、温度、酸碱性等)而移动的。
以下列表归纳了外界条件变化对电离平衡及c(H)的影响,这里假设弱电解质AB可以电离成A+和B-,且电离过程吸热,则
电离方程式 | AB⇌A++B- | |
条件改变内容 | v(正),v(逆)关系 | 平衡移动方向 |
增大c(AB) | v(正)>v(逆) | 向右 |
减小c(AB) | v(正)<v(逆) | 向左 |
增大c(A) | v(正)<v(逆) | 向左 |
减小c(A) | v(正)>v(逆) | 向右 |
增大c(B) | v(正)<v(逆) | 向左 |
减小c(B) | v(正)>v(逆) | 向右 |
稀释溶液 | v(正)>v(逆) | 向右 |
升高温度 | v(正)>v(逆) | 向右 |
降低温度 | v(正)<v(逆) | 向左 |
为了便于理解,可以参考醋酸(CH3COOH)的电离平衡,将CH3COOH代入上表的AB,将H+代入A+,将CH3COO-代入B-。
另外,电离平衡也遵循勒夏特列原理。
弱电解质AxBy在水溶液中达到电离平衡时:
式中
电离平衡常数的大小反映弱电解质的电离程度,不同温度时有不同的电离常数。
在同一温度下,同一电解质的电离平衡常数相同,但随着弱电解质浓度的降低,转化率会增大。由该温度下的解离度a=(K/起始浓度)的算术平方根,可得知:弱电解质浓度越低电离程度越大 。
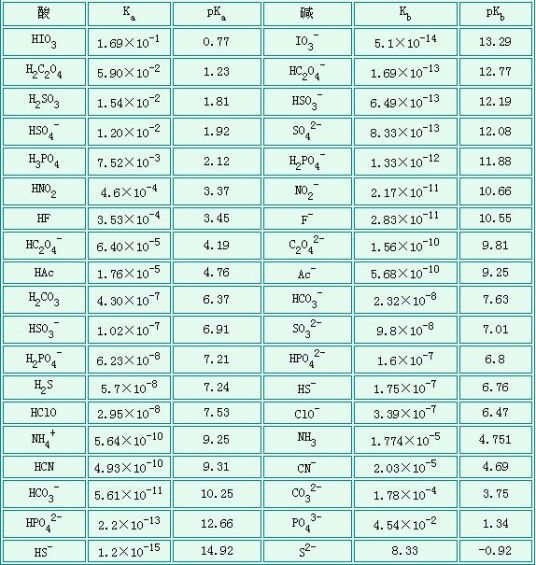
弱电解质电离常数
条件是在室温下(25°C)。Ka表示弱酸的电离常数,Kb表示弱碱的电离常数,pKa(pKb)表示其负对数。
弱酸
名称 | Ka | pKa | |
砷酸 | H3AsO4 | 6.2×10-3(Ka1) 1.2×10-7(Ka2) 3.1×10-12(Ka3) | 2.21 6.93 11.51 |
亚砷酸 | H3AsO3 | 5.1×10-10 | 9.29 |
硼酸 | H3BO3 | 5.8×10-10 | 9.24 |
次溴酸 | HBrO | 2.3×10-9 | 8.63 |
HCN | 6.2×10-10 | 9.21 | |
HCNO | 3.3×10-4 | 3.48 | |
碳酸 | H2CO3 | 4.45×10-7(Ka1) 4.7×10-11(Ka2) | 6.352 |
次氯酸 | HClO | 2.98×10-8 | 7.526 |
亚氯酸 | HClO2 | 1.1×10-2 | 1.95 |
铬酸 | H2CrO4 | 3.2×10-7(Ka2) | 6.50 |
氢氟酸 | HF | 6.8×10-4 | 3.17 |
次碘酸 | HIO | 2.3×10-11 | 10.64 |
碘酸 | HIO3 | 0.49 | 0.31 |
亚硝酸 | HNO2 | 7.1×10-4 | 3.15 |
过氧化氢 | H2O2 | 2.2×10-12 | 11.65 |
次磷酸 | H3PO2 | 5.9×10-2 | 1.23 |
磷酸 | H3PO4 | 7.11×10-3(Ka1) 6.23×10-8(Ka2) 4.5×10-13(Ka3) | 2.18 7.199 12.35 |
H4P2O7 | 0.20(Ka1) 6.5×10-3(Ka2) 1.6×10-7(Ka3) 2.6×10-10(Ka4) | 0.70 2.19 6.80 9.59 | |
亚磷酸 | H3PO3 | 3.7×10-2(Ka1) 2.9×10-7(Ka2) | 1.43 6.54 |
氢硫酸 | H2S | 1.3×10-7(Ka1) 7.1×10-15(Ka2) | 6.88 14.15 |
硫酸 | H2SO4 | 1.02×10-2(Ka2) | 1.99 |
亚硫酸 | H2SO3 | 1.23×10-2(Ka1) 5.6×10-8(Ka2) | 1.91 7.18 |
硫氰酸 | HSCN | 0.13 | 0.9 |
硫代硫酸 | H2S2O3 | 0.25(Ka1) 1.9×10-2(Ka2) | 0.60 1.72 |
偏硅酸 | H2SiO3 | 1.7×10-10(Ka1) 1.6×10-12(Ka2) | 9.77 11.8 |
HCOOH | 1.80×10-4 | 3.745 | |
HOOC-COOH | 5.60×10-2(Ka1) 5.42×10-5(Ka2) | 1.252 4.266 | |
CH3COOH | 1.75×10-5 | 4.757 | |
丙酸 | C2H5COOH | 1.34×10-5 | 4.874 |
乳酸(D-2-羟基丙酸) | CH3CH(OH)COOH | 1.38×10-4 | 3.860 |
C6H5OH | 1.0×10-10 | 9.98 | |
苯甲酸 | C6H5COOH | 6.28×10-5 | 4.202 |
水杨酸(2-羟基-苯甲酸) | C7H6O3 | 1.0×10-3(COOH) 2.2×10-14(OH) | 2.98 13.66 |
邻苯二甲酸 | C8H6O4 | 1.12×10-3(Ka1) 3.91×10-6(Ka2) | 2.950 5.408 |
C6H8O7 | 7.44×10-4(Ka1) 1.73×10-5(Ka2) 4.02×10-7(Ka3) | 3.128 4.761 6.396 |
弱碱
名称 | 化学式 | Kb | pKb |
NH3·H2O | 1.8×10-5 | 4.74 | |
联氨(肼) | N2H4 | 3.0×10-6(Kb1) 7.6×10-15(Kb2) | 5.52 14.12 |
苯胺 | C6H5NH2 | 4.2×10-10 | 9.38 |
NH2OH | 9.1×10-9 | 8.04 | |
甲胺 | CH3NH2 | 4.2×10-4 | 3.38 |
乙胺 | C2H5NH2 | 5.6×10-4 | 3.25 |
上一篇 子宫内膜炎治疗后,有概率复发吗?
下一篇 子宫内膜炎平时应如何检测病情?