-
水合物 编辑
水合物指的是含有水的化合物,其范围相当广泛。其中水可以以配位键与其他部分相连,如水合金属离子,也可以是以共价键相结合,如水合三氯乙醛。也可以指是天然气中某些组分与水分在一定温度、压力条件下形成的白色晶体,外观类似致密的冰雪,密度为0.88~0.90 g/cm3。水合物是一种笼形晶体包络物,水分子借氢键结合形成笼形结晶,气体分子被包围在晶格之中。
中文名:水合物
外文名:Hydrate
别名:水化物
结构
低分子的气体的水合物为体心立方晶格,较大的气体分子则是类似于金刚石的晶体结构。
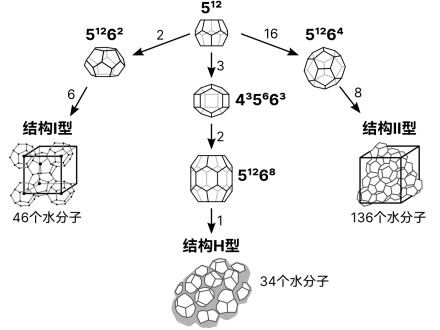 天然气水合物结构
天然气水合物结构
分类
水合物化学式具有确定数目的水分子, 其结构大体可分为4类:
(1)全部H2O分子配位于金属阳离子。例如, 六水合物Co(ClO4)2·6H2O中的6个H2O分子全部配位于Co2+离子, 可将其写成(ClO4)2。
(2)部分H2O分子配位于金属阳离子,部分H2O分子键合于酸根阴离子。例如CuSO4·5H2O中的H2O分子。
(3)H2O分子进入固体晶格的确定位置,不与特定的阳离子或阴离子键合。这种化合物中的水分子叫晶格水,例如BaCl2·2H2O中的水分子。
(4)一部分H2O分子与阳离子配位,另一部分则是晶格水。明矾KAl(SO4)2·12H2O似乎具有这种结构。
最后还应该提到水合包合物。它们应该归入水合物, 但却不是从其组成离子的水溶液中结晶出来的化合物。它们是H2O分子彼此间通过氢键形成笼, 将外来的电中性分子或离子包于笼内而得到的一类水合物。例如Cl2(H2O)7.25 和“可燃冰”。
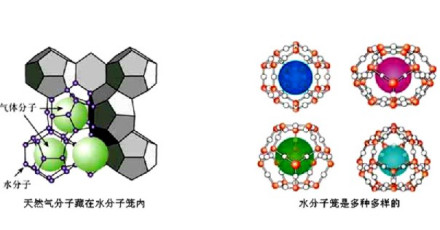 天然气水合物
天然气水合物
CuSO4· 5H2O按水分子的结合方式,其结构式可以写成【Cu(H2O)4】 【SO4(H2O)】。许多其他水合硫酸盐晶体如 FeSO4·7H2O、NiSO4·7H2O、ZnSO4·7H2O等,均有相同的结合方式。
结合方式与性质变化
在过渡金属的水合物中,相同组成的水合物往往由于其中的水分子的结合方式不同而使其性质发生变化。例如无水三氯化铬呈红紫色;其水合物为暗绿色晶体,实验式为CrCl3·6H2O。经实验证明,6个水分子中只有4个水分子和 2个氯离子作为配体与铬离子结合在内界 【Cr(H2O)4Cl2】+, 不论在晶态或在水溶液中均稳定存在,因此,这种水合物的结构式可写成【Cr(H2O)4Cl2】Cl·2H2O。如将暗绿色晶体的溶液冷却至0℃以下并通入氯化氢HCl气体,则析出紫色晶体,其结构式为【Cr(H2O)6】Cl3。将紫色晶体的溶液用乙醚处理并通以氯化氢气体,就析出一种淡绿色晶体,其结构式为【Cr(H2O)5Cl】Cl2·H2O。三者的转化表示如下:
水也可以不直接与阳离子或阴离子结合而依一定比例存在于晶体内,在晶格中占据一定的部位。这种结合形式的水称为晶格水,一般含有12个水分子。有些晶形化合物也含水,但无一定比例。例如沸石和其他硅酸盐矿物。一些难溶的金属氢氧化物实际上也是水合物。
液态水的存在是生成水合物的必要条件。
(2)低温
低温是形成水合物的重要条件,天然气的温度必须等于或低于天然气中水汽的露点。
(3)高压
组成相同的气体,水合物生成温度随压力升高(降低)而升高(降低)。
(4)其它条件
压力的波动,气流方向改变及微小水化晶的存在。